题目内容
【题目】常温下,二甲胺[(CH3)2NH·H2O]是一元弱碱,其电离常数Kb=1.6×10-4。10 mL c mol·L-1二甲胺溶液中滴加0.1mo1·L-1盐酸,混合溶液的温度与盐酸体积的关系如图所示。下列说法不正确的

A. 二甲胺溶液的浓度为0.2mol·L-1
B. 在Y和Z点之间某点溶液pH=7
C. Y点存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. 常温下,(CH3)2NH2Cl水解常数Kh≈5.0×10-11
【答案】B
【解析】
A、溶液温度最高,即Y点表示酸碱恰好完全反应;
B、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,X点对应的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的浓度相等,其混合溶液呈碱性,故中性点应在X点与Y点之间;
C、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性;
D、Kh=Kw/Kb=1×10-14/1.6×10-4≈5.0×10-11;
A、二甲胺与盐酸恰好完全中和时放出热量最多,溶液温度最高,即Y点表示酸碱恰好完全反应。根据(CH3)2NH·H2O+HCl=(CH3)2NH2Cl+H2O,c=0. 2mol·L-1,故A项正确;
B、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,X点对应的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的浓度相等,其混合溶液呈碱性,故中性点应在X点与Y点之间,故B错误;
C、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,Y点存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-),故C正确;
D、Kh=Kw/Kb=1×10-14/1.6×10-4≈5.0×10-11,故D正确;
故选B。

【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
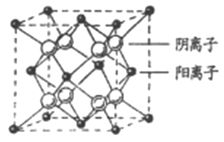
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。