题目内容
下列叙述中正确的是( )A.用铂电极电解NaOH溶液,一段时间后,溶液中溶质的质量分数不变
B.用电解法精炼粗铜时,粗铜作阴极
C.用惰性电极电解100mL饱和食盐水,生成112mL氢气(标况)时,氢氧根离子浓度约为0.05mol/L(假定溶液体积仍为100mL)
D.铜锌原电池工作时,正极从外电路得到电子
【答案】分析:A、根据电解氢氧化钠溶液时,溶剂和溶质的质量是否变化判断;
B、电解精炼时,粗金属作阳极,精金属作阴极;
C、根据电解时的电池反应式计算生成的氢氧化钠的物质的量,再根据物质的量浓度公式计算氢氧根离子的物质的量浓度;
D、原电池放电时,根据正负极上得失电子判断.
解答:解:A、用铂电极电解NaOH溶液时,阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,导致溶液中氢氧化钠的量不变,水的质量减少,所以一段时间后,溶液中溶质的质量分数增大,故A错误;
B、用电解法精炼粗铜时,粗铜作阳极,精铜作阴极,故B错误;
C、用惰性电极电解100mL饱和食盐水,生成112mL氢气(标况)时,阳极上生成112mL氯气,根据电池反应方程式计算生成的氢氧化钠的物质的量.
设生成氢氧化钠的物质的量为x.
2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
22.4L 2mol
0.112L x
x=0.01mol,氢氧根离子浓度C=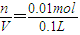 =0.1mol/L,故C错误;
=0.1mol/L,故C错误;
D、铜锌原电池工作时,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿外电路流向正极,所以正极从外电路得到电子,故D正确.
故选D.
点评:本题考查了原电池原理和电解池原理,难度不大,会根据电池反应式计算C选项中氢氧根离子的浓度.
B、电解精炼时,粗金属作阳极,精金属作阴极;
C、根据电解时的电池反应式计算生成的氢氧化钠的物质的量,再根据物质的量浓度公式计算氢氧根离子的物质的量浓度;
D、原电池放电时,根据正负极上得失电子判断.
解答:解:A、用铂电极电解NaOH溶液时,阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,导致溶液中氢氧化钠的量不变,水的质量减少,所以一段时间后,溶液中溶质的质量分数增大,故A错误;
B、用电解法精炼粗铜时,粗铜作阳极,精铜作阴极,故B错误;
C、用惰性电极电解100mL饱和食盐水,生成112mL氢气(标况)时,阳极上生成112mL氯气,根据电池反应方程式计算生成的氢氧化钠的物质的量.
设生成氢氧化钠的物质的量为x.
2NaCl+2H2O
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH22.4L 2mol
0.112L x
x=0.01mol,氢氧根离子浓度C=
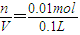 =0.1mol/L,故C错误;
=0.1mol/L,故C错误;D、铜锌原电池工作时,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿外电路流向正极,所以正极从外电路得到电子,故D正确.
故选D.
点评:本题考查了原电池原理和电解池原理,难度不大,会根据电池反应式计算C选项中氢氧根离子的浓度.

练习册系列答案
相关题目
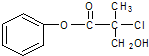 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


