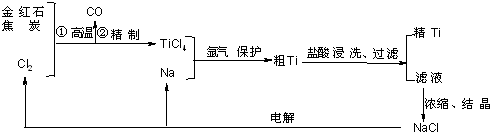
题目内容
完成下列离子方程式(给出物质的计量数不能改变)
(1)1______+6H+═2Fe3++3______;
(2)1______+Ca2++2______═1CaCO3↓+1______.
解:(1)由反应后生成铁离子,则反应为氧化铁和酸反应,离子反应为Fe2O3+6H+═2Fe3++3H2O,
故答案为:Fe2O3;H2O;
(2)由反应前存在钙离子,反应后生成碳酸钙沉淀,该反应为二氧化碳与石灰水反应,
离子反应为CO2+Ca2++2OH-═CaCO3↓+H2O,故答案为:CO2;OH-;H2O.
分析:(1)由反应后生成铁离子,则反应前为氧化铁;
(2)由反应前存在钙离子,反应后生成碳酸钙沉淀,及给出的化学计量数不变,则为二氧化碳与石灰水反应.
点评:本题考查离子反应方程式的书写,能根据给出的离子推出反应是解答本题的关键,熟悉常见的离子及反应即可解答,难度不大.
故答案为:Fe2O3;H2O;
(2)由反应前存在钙离子,反应后生成碳酸钙沉淀,该反应为二氧化碳与石灰水反应,
离子反应为CO2+Ca2++2OH-═CaCO3↓+H2O,故答案为:CO2;OH-;H2O.
分析:(1)由反应后生成铁离子,则反应前为氧化铁;
(2)由反应前存在钙离子,反应后生成碳酸钙沉淀,及给出的化学计量数不变,则为二氧化碳与石灰水反应.
点评:本题考查离子反应方程式的书写,能根据给出的离子推出反应是解答本题的关键,熟悉常见的离子及反应即可解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
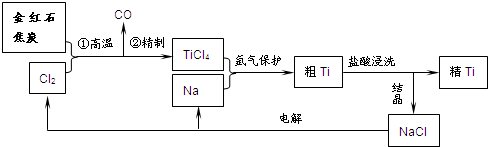

 (2011?漳州一模)某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
(2011?漳州一模)某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应: MnO4-+
MnO4-+ SO2+
SO2+
 Mn2++
Mn2++ SO42-+
SO42-+ H+
H+