题目内容
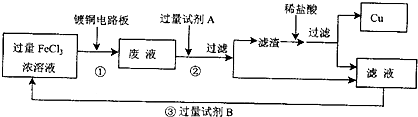
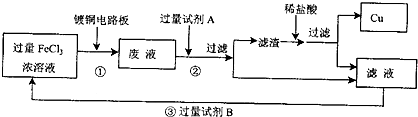
电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeCl3溶液,需要下列试剂:①蒸馏水、②铁粉、③浓H2SO4、④浓盐酸、⑤烧碱、⑥浓氨水、⑦Cl2中的( )
A.①②④⑦ B.①③④⑥
C.②④⑥⑦ D.①④⑥⑦
A
解析:
用FeCl3溶液腐蚀印刷电路板发生的反应为:2Fe3++Cu=Cu2++2Fe2+,用蒸馏水稀释腐蚀后的废液;其中存在Fe2+和Cu2+,加入足量铁粉,Fe+Cu2+=Fe2++Cu,过滤后可得到Cu粉和Fe粉的混合物,此时再加入浓盐酸,将Fe粉溶解,过滤后即可回收Cu。在原滤液(主要是Fe2+)中通入足量Cl2则可得到FeCl3溶液,归纳所用试剂为:蒸馏水,铁粉,浓盐酸,氧气。
错因分析:错解B。①忽略加入水后2Fe3++Cu=Cu2++2Fe2+。②加入浓H2SO4后,会产生Fe2+被氧化成Fe3+,但却从外界引入了SO42-,且不易除去,所以氧化剂应选Cl2,而不是浓H2SO4。③最后加入NH3·H2O,会形成Fe(OH)3和Cu(OH)2沉淀,而达不到提纯FeCl3的目的。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeCl3溶液,需要下列试剂:①蒸馏水、②铁粉、③浓H2SO4、④浓盐酸、⑤烧碱、⑥浓氨水、⑦Cl2中的( )
| A、①②④⑦ | B、①③④⑥ | C、②④⑥⑦ | D、①④⑥⑦ |