题目内容
【题目】二氧化氯消毒剂是国际上公认的含氯消毒剂中唯一的高效消毒灭菌剂,实验室中KClO3和浓盐酸在一定温度下反应会生成二氧化氯,其变化可表述为:
2KClO3 +4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况:(单线桥法表示)________________。
(2)氧化剂与还原剂的物质的量之比是________________。
(3)若产生标况下22.4 L Cl2,则转移的电子的物质的量为________________mol。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm—3,为使用方便,请计算出该浓盐酸中HCI的物质的量浓度________________mol·L—l。
【答案】 ![]() 1:1 2 11.9
1:1 2 11.9
【解析】该反应中KClO3中氯元素化合价由+5得一个电子变成+4价,HCl中氯元素由-1价失一个电子变成0价,转移电子数是2,(1)用单线桥法可表示为:
![]() ;
;
(2)KClO3中氯元素化合价降低为氧化剂,HCl中氯元素化合价升高生成氯气部分为还原剂,另有一半化合价不变生成氯化钾做为酸的作用,故氧化剂和还原剂的物质的量之比是2:2=1:1;
(3)由反应可知,产生标况下22.4 L Cl2时,即1mol Cl2,转移2mol电子;
(4)质量分数为36.5%,密度为1.19 g·cm—3的浓盐酸,根据![]() 计算:
计算:
![]() =11.9mol。
=11.9mol。

【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
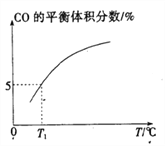
①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。
【题目】下表列出了周期表中前20号元素中的十种元素的相关数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +1 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | — |
最低价态 | — | — | -2 | — | -4 | -3 | -1 | — | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是________(填元素编号),其最高价氧化物的水化物的电子式为___________;与H2最容易化合的非金属单质是________(写物质名称)。
(2)写出元素③形成的一种具有强氧化性的氢化物的结构式______________。
(3)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式______________;⑤的最高价氧化物的电子式为__________。
(4)短周期另一元素Q的原子半径为1.02×10-10m,则该元素在周期表中位于________________。
(5)写出④的最高价氧化物的水化物与⑦的最高价氧化物的水化物反应的离子方程式:________________________________________________________。
