��Ŀ����
����Ŀ������˵���в���ȷ���ǣ� ��
A. �ڽ�����ұ�������У����ȷ��������������Ȼ�ԭ��
B. ��ѧ����˵�ĸ�������ʵ���Ǹ֣������������ǻ��������Ǵ�����
C. ���ڷ�Ӧ��FeCuS2 + S![]() FeS2 + CuS������FeS2���������������ǻ�ԭ����
FeS2 + CuS������FeS2���������������ǻ�ԭ����
D. ��֪BrCl�Ļ�ѧ���ʸ�Cl2���ƣ���BrCl��ˮ��Ӧ������HCl��HBrO��Ҳ��������ԭ��Ӧ
���𰸡�D
��������A. �ڽ�����ұ�������У����ȷ��������û���Ӧ�����ǻ�ԭ���������������Ȼ�ԭ����A��ȷ��B. ��ѧ����˵�ĸ�������ʵ���Ǹ֣������������ǻ��������Ǵ�������B��ȷ��C. FeCuS2��SԪ�ػ��ϼ۴ӣ�2�����ߵ���1�ۣ�����S����Ԫ�ػ��ϼ۴�0�۽��͵���1�ۣ����FeS2���������������ǻ�ԭ������C��ȷ��D. ��֪BrCl�Ļ�ѧ���ʸ�Cl2���ƣ���BrCl��ˮ��Ӧ����HCl��HBrO����Ӧ��Ԫ�صĻ��ϼ۾����仯������������ԭ��Ӧ��DΪ����ѡD��

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�����Ŀ������ʯ����Կ�����MgO��Fe2O3��Al2O3��SiO2��ɡ�������ʯ��ȡ��ʽ̼��þ��ʵ�鲽������ͼ��ʾ��
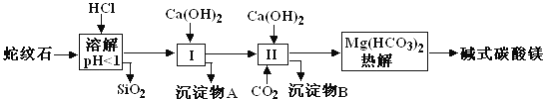
��1������ʯ�������ܽ����Һ�����Mg2���⣬�����еĽ���������__________��
��2������������ʱ��������ҺpH��7��8(�й��������������pH���±�)��
�������� | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
��ʼ����pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2���ܹ�������Ca(OH)2�������ܻᵼ��__________�ܽ⡢________������
��3���ӳ��������A����ȡ��ɫ�����������ϣ����������A�м���__________(��д���ʵĻ�ѧʽ)��Ȼ����ˡ�ϴ�ӡ�������
��4�������һ��ʵ�飬ȷ����ƷaMgCO3bMg(OH)2cH2O��a��b��c��ֵ������������ʵ�鲽��(�����Լ���Ũ���ᡢ��ʯ��)��
����Ʒ���� �ڸ��·ֽ�
�� ______________________________________________________��
�ܳ�����ʯ������CO2ǰ������� ��MgO����
��5��18.2 g��Ʒ��ȫ�ֽ����6.6 g CO2��8.0 g MgO���ɴ˿�֪����Ʒ�Ļ�ѧʽ�У�a��____________��b��____________��c��____________��
����Ŀ��Ϊȷ����Ͼ��ȵ�NH4NO3�ͣ�NH4��2SO4��Ʒ��ɣ���ȡ4����Ʒ�ֱ����50.0mL��ͬŨ�ȵ�NaOH��Һ�У����ȳ�ַ�Ӧ����Һ�е�笠�����ȫ��ת��Ϊ�������Ҽ��Ⱥ���ȫ���ݳ���������Ļ����������Ͳ����������������״�����Ĺ�ϵ�����
ʵ����� | I | II | III | IV |
NaOH��Һ�������mL�� | 50.0 | 50.0 | 50.0 | 50.0 |
��Ʒ������g�� | 3.44 | m | 17.2 | 21.5 |
NH3�����L�� | 1.12 | 2.24 | 5.60 | 5.60 |
�Լ��㣺
��1��m=_____g��c��NaOH��=_____molL��1��
��2����Ʒ��NH4NO3�ͣ�NH4��2SO4���ʵ���֮��Ϊ_____��