题目内容
【题目】将大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO47H2O),实验操作过程如下: 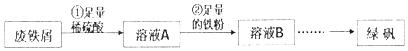
已知:杂质不溶于稀硫酸.
请回答下列问题:
(1)步骤①中,稀硫酸与Fe2O3反应的方程式为 , 废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 .
(2)步骤②中溶液A与铁粉反应的离子方程式为 .
(3)检验溶液B中是否还存在Fe3+的方法是 .
【答案】
(1)Fe2O3+6H+=2Fe3++3H2O;过滤
(2)Fe+2Fe3+=3Fe2+
(3)取少量B溶液于试管中,滴加KSCN溶液,若溶液出现血红色,则哦人们能够用中仍存在Fe3+,反之不含
【解析】解:步骤①中,稀硫酸与Fe2O3反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是过滤,
所以答案是:Fe2O3+6H+=2Fe3++3H2O;过滤;(2)步骤②中溶液A与铁粉反应的离子方程式为Fe+2Fe3+=3Fe2+,
所以答案是:Fe+2Fe3+=3Fe2+;(3)检验溶液B中是否还存在Fe3+的方法是取少量B溶液于试管中,滴加KSCN溶液,若溶液出现血红色,则哦人们能够用中仍存在Fe3+,反之不含,所以答案是:取少量B溶液于试管中,滴加KSCN溶液,若溶液出现血红色,则哦人们能够用中仍存在Fe3+,反之不含.

练习册系列答案
相关题目


