题目内容
10. 电能是现代社会应用最广泛的能源之一.原电池是一种将化学能转化为电能的装置.如图所示的锌、铜和稀硫酸组成的原电池中,锌片上发生氧化反应(填“氧化”或“还原”).铜片上的电极反应式是2H++2e-=H2↑.能否根据反应NaOH+HCl=NaCl+H2O 设计成原电池,否(填“能”或“否”),原因是该反应不是氧化还原反应,没有电子转移.
电能是现代社会应用最广泛的能源之一.原电池是一种将化学能转化为电能的装置.如图所示的锌、铜和稀硫酸组成的原电池中,锌片上发生氧化反应(填“氧化”或“还原”).铜片上的电极反应式是2H++2e-=H2↑.能否根据反应NaOH+HCl=NaCl+H2O 设计成原电池,否(填“能”或“否”),原因是该反应不是氧化还原反应,没有电子转移.
分析 根据原电池的定义分析;根据原电池中活泼金属为负极发生失电子的氧化反应,不活泼的金属为正极发生得电子的还原反应;根据原电池反应必须是自发进行的放热的氧化还原反应判断.
解答 解:原电池是把化学能转变为电能的装置;在Cu、Zn和稀硫酸组成的原电池中,锌失电子变成离子进入溶液,发生氧化反应,所以锌是负极,电极反应式为Zn-2e-=Zn2+.铜片上氢离子得电子发生还原反应,所以铜是正极,电极反应式为2H++2e-=H2↑;因为NaOH+HCl=NaCl+H2O不是氧化还原反应,所以不能设计成原电池,
故答案为:化学;氧化;2H++2e-=H2↑;否;该反应不是氧化还原反应,没有电子转移.
点评 本题考查了原电池的定义、工作原理以及原电池的设计,注意电极反应式书写,原电池反应必须是自发进行的放热的氧化还原反应,难度不大.

练习册系列答案
相关题目
20.1mol某链烃最多能与2mol HCl发生加成反应,生成氯代烃,1mol该氯代烃最多能与6mol的Cl2发生取代反应,则该烃可能是( )
| A. | CH2═CH-CH═CH2 | B. | HC≡C-CH3 | C. | CH3-C≡C-CH3 | D. | CH2═CH-CH3 |
1.下列反应中,反应物总能量低于生成物总能量的是( )
| A. | CaO与H2O反应 | B. | CH4在O2中燃烧 | ||
| C. | NaOH溶液与H2SO4溶液反应 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
5.元素X、Y、Z均为短周期元素且原子序数之和为35,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
| A. | 三种元素的原子序数 Y>X>Z | |
| B. | 三种元素的原子半径 X>Y>Z | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Z的最高价氧化物的水化物酸性最强 |
15. 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低
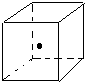
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$ Si(s)+4HCl(g)计算该反应的反应热△H为+236kJ/mol.
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$ Si(s)+4HCl(g)计算该反应的反应热△H为+236kJ/mol.
2.以下有关原子结构及元素周期律、元素周期表的叙述正确的是( )
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | 元素周期表有十八个纵列,共十六个族 | |
| C. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 第2周期元素从左到右,最高正价从+1递增到+7 |
19.一定温度下的恒容密闭容器中,反应A2(g)+B2(g)?2AB(g) 达到平衡的标志是( )
| A. | 容器内n(A2):n(B2):n(AB)=1:1:2 | |
| B. | 单位时间内生成2nmolAB,同时生成nmolA2 | |
| C. | 生成B的速率与生成A的速率相等 | |
| D. | 容器内气体的密度不随时间变化 |

 命名为2-甲基-1,3-丁二烯.
命名为2-甲基-1,3-丁二烯.