题目内容
(14分)食盐是日常生活的必需品,也是重要的化工原料。
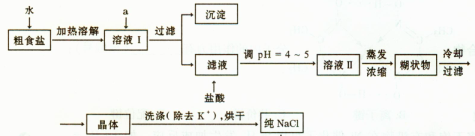
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO2-4'等杂质离子,实验室提纯NaCl的流 程如下:
程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO2-4离子,选出a所代表的试剂,按滴加顺序依次为 (填化学式);滤液中滴加盐酸调pH ="4" ~5的目的是 ;
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量KCl,检验NaCl是否洗净的操作是 ;
(2)用提纯的NaCl配制480mL 4.00mol·L-1NaCl溶液,需要称取的质量为 g,所用仪器除药匙、玻璃棒、烧杯外还有 (填仪 器名称);
器名称);
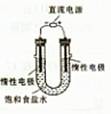
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____(填“>”、“=”或“<”)2L,主要原因是 。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO2-4'等杂质离子,实验室提纯NaCl的流
 程如下:
程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO2-4离子,选出a所代表的试剂,按滴加顺序依次为 (填化学式);滤液中滴加盐酸调pH ="4" ~5的目的是 ;
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量KCl,检验NaCl是否洗净的操作是 ;
(2)用提纯的NaCl配制480mL 4.00mol·L-1NaCl溶液,需要称取的质量为 g,所用仪器除药匙、玻璃棒、烧杯外还有 (填仪
 器名称);
器名称);(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____(填“>”、“=”或“<”)2L,主要原因是 。

(1)①BaCl2、、NaOH、Na2CO3或、NaOH、BaCl2、Na2CO3或BaCl2、、Na2CO3、
NaOH(2分)(错选、多选不得分)②中和溶液中过量的OH-、CO32-;(2分)(2)用干
净的铂丝取最后一次洗涤液放在火焰上灼烧,透过蓝色钴玻璃未见紫色则已洗干净;(2分)
(2)117(2分),天平、500mL容量瓶、胶头滴管;(2分)(3)<,(2分)电解生成的
Cl2与NaOH反应. (2分)
NaOH(2分)(错选、多选不得分)②中和溶液中过量的OH-、CO32-;(2分)(2)用干
净的铂丝取最后一次洗涤液放在火焰上灼烧,透过蓝色钴玻璃未见紫色则已洗干净;(2分)
(2)117(2分),天平、500mL容量瓶、胶头滴管;(2分)(3)<,(2分)电解生成的
Cl2与NaOH反应. (2分)
(1)欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,分别用Na2CO3、、NaOH、
NaOH 、BaCl2且所加试剂要过量,过量的试剂在后续操作中被除,因此Na2CO3、加在
BaCl2后,过量的Na2CO3、、NaOH可用盐酸除;当洗涤液中无K+,则洗干净了,因此取最
后一次洗涤液做焰色反应即可;(2)由于没有480mL容量瓶,所以只能配500mL 溶液,即
0.5x4.00x58.5=117;(3)由于Cl2与NaOH反应而使收集的Cl2<2L。
NaOH 、BaCl2且所加试剂要过量,过量的试剂在后续操作中被除,因此Na2CO3、加在
BaCl2后,过量的Na2CO3、、NaOH可用盐酸除;当洗涤液中无K+,则洗干净了,因此取最
后一次洗涤液做焰色反应即可;(2)由于没有480mL容量瓶,所以只能配500mL 溶液,即
0.5x4.00x58.5=117;(3)由于Cl2与NaOH反应而使收集的Cl2<2L。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目