题目内容
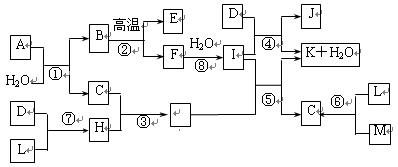
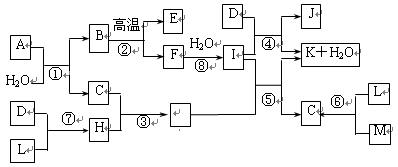
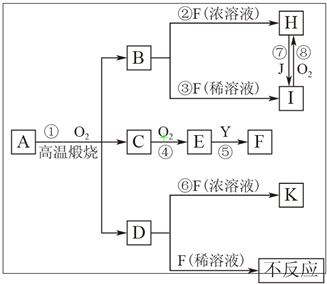 物质A由3种元素组成,在一定量O2中高温煅烧经复杂反应生成B、C、D的物质的量之比为1:2:1,D、J为常见金属,B、C为氧化物,Y为无色无味液体.物质A存在如下转化关系(有些反应的反应物和生成物中的水未标出):
物质A由3种元素组成,在一定量O2中高温煅烧经复杂反应生成B、C、D的物质的量之比为1:2:1,D、J为常见金属,B、C为氧化物,Y为无色无味液体.物质A存在如下转化关系(有些反应的反应物和生成物中的水未标出):请回答下列问题:
(1)A的化学式是
CuFeS2
CuFeS2
.(2)④、⑥反应的化学方程式是
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
;
| ||
| △ |
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(3)⑦反应的离子方程式是
Fe+2Fe3+═3Fe2+
Fe+2Fe3+═3Fe2+
.(4)检验H中阳离子的方法是
取少量试样,加入KSCN溶液,试样变红色则证明Fe3+存在
取少量试样,加入KSCN溶液,试样变红色则证明Fe3+存在
.分析:由框图可知F溶液为一种酸,且其浓溶液具有氧化性,又由D与F稀溶液不反应可推知F为H2SO4,D为Cu,则C为SO2,E为SO3,由H和I之间的转化关系及J为金属单质可推知J为Fe,H为Fe2(SO4)3,I为FeSO4,由A高温燃烧的产物情况可推知B为FeO,B、C、D的物质的量之比为1:2:1,物质A由3种元素组成,根据原子守恒可知,可知A为CuFeS2,据此解答.
解答:解:由框图可知F溶液为一种酸,且其浓溶液具有氧化性,又由D与F稀溶液不反应可推知F为H2SO4,D为Cu,则C为SO2,E为SO3,由H和I之间的转化关系及J为金属单质可推知J为Fe,H为Fe2(SO4)3,I为FeSO4,由A高温燃烧的产物情况可推知B为FeO,B、C、D的物质的量之比为1:2:1,物质A由3种元素组成,根据原子守恒可知,可知A为CuFeS2,
(1)由上述分析可知,A为CuFeS2,故答案为:CuFeS2;
(2)反应④的化学方程式为:2SO2+O2
2SO3,反应⑥的化学方程式是:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:2SO2+O2
2SO3;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(3)反应⑦的离子方程式是:Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+═3Fe2+;
(4)检验H中阳离子的方法是:取少量试样,加入KSCN溶液,试样变红色则证明Fe3+存在,
故答案为:取少量试样,加入KSCN溶液,试样变红色则证明Fe3+存在.
(1)由上述分析可知,A为CuFeS2,故答案为:CuFeS2;
(2)反应④的化学方程式为:2SO2+O2
| ||
| △ |
| ||
故答案为:2SO2+O2
| ||
| △ |
| ||
(3)反应⑦的离子方程式是:Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+═3Fe2+;
(4)检验H中阳离子的方法是:取少量试样,加入KSCN溶液,试样变红色则证明Fe3+存在,
故答案为:取少量试样,加入KSCN溶液,试样变红色则证明Fe3+存在.
点评:本题考查无机物的推断,涉及Cu、Fe元素单质及其化合物性质、硫酸的性质等,根据转化关系确定F为酸是关键,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
相关题目
 两容积相等的密闭容器。
两容积相等的密闭容器。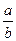 ________
________ 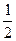 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。