题目内容
COCl2(g)?CO(g)+Cl2(g),△H>0.当反应达到平衡时,下列措施:①升温 ②恒压通入惰性气体③增加CO的浓度 ④减压 ⑤加催化剂,能提高COCl2转化率的是( )
分析:化学反应COCl2(g)?CO(g)+Cl2(g)△H>0;是气体体积增大的反应,正向反应是吸热反应;转化率的变化根据化学平衡的移动方向分析判断.
①升温平衡向吸热反应方向移动;
②恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行;
③增加CO的浓度,平衡逆向进行;
④减压平衡向气体体积增大的方向进行,平衡正向进行;
⑤加催化剂,改变速率不改变平衡.
①升温平衡向吸热反应方向移动;
②恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行;
③增加CO的浓度,平衡逆向进行;
④减压平衡向气体体积增大的方向进行,平衡正向进行;
⑤加催化剂,改变速率不改变平衡.
解答:解:化学反应COCl2(g)?CO(g)+Cl2(g)△H>0;是气体体积增大的反应,正向反应是吸热反应;
①升温平衡向吸热反应方向移动;平衡正向进行,COCl2转化率增大,故①符合;
②恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行;COCl2转化率增大,故②符合;
③增加CO的浓度,平衡逆向进行;COCl2转化率减小,故③不符合;
④减压平衡向气体体积增大的方向进行,平衡正向进行;COCl2转化率增大,故④符合;
⑤加催化剂,改变速率不改变平衡;COCl2转化率不变,故⑤不符合;
综上所述:①②④正确,
故选B.
①升温平衡向吸热反应方向移动;平衡正向进行,COCl2转化率增大,故①符合;
②恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行;COCl2转化率增大,故②符合;
③增加CO的浓度,平衡逆向进行;COCl2转化率减小,故③不符合;
④减压平衡向气体体积增大的方向进行,平衡正向进行;COCl2转化率增大,故④符合;
⑤加催化剂,改变速率不改变平衡;COCl2转化率不变,故⑤不符合;
综上所述:①②④正确,
故选B.
点评:本题考查了化学平衡的影响因素的分析判断,体积改变,平衡移动方向是判断的关键,题目难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
T K时,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
|
光气(COCl2)的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H=+108kJ?mol-1.反应体系中各物质的浓度在不同条件下的变化如图8所示(10~14min的COCl2浓度变化未标出):
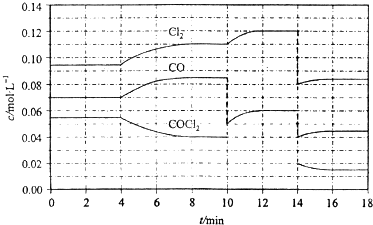
下列说法正确的是( )

下列说法正确的是( )
| A、COCl2在5~6 min和15~16 min时平均反应速率:v(5~6)>v(15~16) | B、第10 min时,改变反应条件,反应重新达到平衡前:v(正)<v(逆) | C、第12 min时,反应重新达到平衡,c(COCl2)≈0.03 mol?L-1 | D、第14 min时,改变的条件是减小压强,随着平衡的移动,COCl2的转化率减小 |
