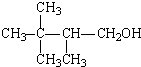
题目内容
【题目】Ⅰ.铁不能与冷、热水反应,但能与水蒸气反应,完成实验Fe与水蒸气的反应,如图所示。
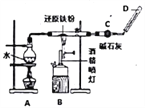
(1)装置A的作用是______________;
(2)B中反应的化学方程式:_______________;
(3)碱石灰的作用是_______________________;
(4)在D处玻璃管口点燃生成的气体前,必须对该气体进行___________________________,这一操作的目的是_____________________________________;
(5)当有8.4g铁粉参加反应时,生成的气体在标准状况下的体积是______________L。
Ⅱ.制备二氧化硫并研究其性质,如图所示。
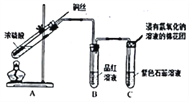
(1)A中铜与浓硫酸反应的化学方程式是_______________________________________;
(2)B、C中的实验现象分别是_________________、___________________;
(3)浸氢氧化钠溶液的棉花团的作用是_________________________,反应的离子方程式是_____________________________。
【答案】 提供水蒸气 3Fe+4H2O(g)![]() Fe3O4+4H2 干燥氢气 验纯 防止点燃时,氢气因含有氧气而爆炸 4.48 L Cu+2H2SO4(浓)
Fe3O4+4H2 干燥氢气 验纯 防止点燃时,氢气因含有氧气而爆炸 4.48 L Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O B中品红溶液褪色 C中石蕊溶液变红 吸收多余的二氧化硫气体,防止污染空气 SO2+2OH-=SO32-+H2O
CuSO4+SO2↑+2H2O B中品红溶液褪色 C中石蕊溶液变红 吸收多余的二氧化硫气体,防止污染空气 SO2+2OH-=SO32-+H2O
【解析】Ⅰ.(1)铁与水蒸气反应,则装置A的作用是提供水蒸气;(2)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2,方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;(3)最后生成的气体为氢气,干燥氢气可以用碱石灰,因此碱石灰的作用是干燥氢气;(4)铁与水蒸气发生氧化还原反应生成氢气,点燃氢气前一定要检验纯度,防止发生爆炸;(5)8.4g铁的物质的量是8.4g÷56g/mol=0.15mol,根据3Fe+4H2O(g)
Fe3O4+4H2;(3)最后生成的气体为氢气,干燥氢气可以用碱石灰,因此碱石灰的作用是干燥氢气;(4)铁与水蒸气发生氧化还原反应生成氢气,点燃氢气前一定要检验纯度,防止发生爆炸;(5)8.4g铁的物质的量是8.4g÷56g/mol=0.15mol,根据3Fe+4H2O(g)![]() Fe3O4+4H2可知当有8.4g铁粉参加反应时,生成氢气0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L;
Fe3O4+4H2可知当有8.4g铁粉参加反应时,生成氢气0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L;
Ⅱ.(1)A中铜与浓硫酸在加热条件下反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;(2)SO2具有漂白性,则B中的实验现象为品红溶液褪色;SO2是酸性氧化物,溶于水显酸性,则C中的实验现象是石蕊溶液变红;(3)SO2是大气污染物,则浸氢氧化钠溶液的棉花团的作用是吸收多余的二氧化硫气体,防止污染空气,反应的离子方程式是SO2+2OH-=SO32-+H2O。
CuSO4+SO2↑+2H2O;(2)SO2具有漂白性,则B中的实验现象为品红溶液褪色;SO2是酸性氧化物,溶于水显酸性,则C中的实验现象是石蕊溶液变红;(3)SO2是大气污染物,则浸氢氧化钠溶液的棉花团的作用是吸收多余的二氧化硫气体,防止污染空气,反应的离子方程式是SO2+2OH-=SO32-+H2O。

 天天练口算系列答案
天天练口算系列答案