题目内容
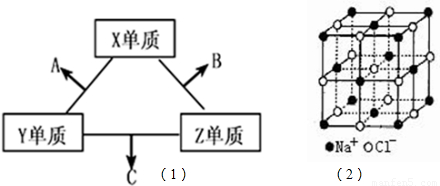
短周期元素在元素中占有重要地位.X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如(1)变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是______周期______族.
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在______.
(3)在C分子中,Y原子的杂化方式为______,与Y原子同主族在第四周期的元素原子基态电子排布式是______.
(4)NaCl的晶体结构如图(2)所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构.则该X的氧化物的化学式为______.
(1)O元素的质子数为8,位于第2周期VIA族;
(2)根据氢键对物质的沸点的影响来分析;
(3)C为NH3,N原子成3个N-H键,含有1对孤对电子对,杂化轨道数目为4,据此确定杂化轨道数目;
与N原子同主族在第四周期的元素为As,As原子核外电子数为33,根据核外电子排布规律书写排布式;
(4)根据均摊法计算晶胞中Xn+、O2-的数目,据此书写.
解答:解:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),B、C两种分子中的电子数均等于10,则B、C为H2O、NH3的一种,且一个B分子中含有的Z原子个数比C分子中少1个,B为H2O,C为NH3,由转化关系可知,Z为氢,故A为NO,X为氧,Y为氮,
(1)O元素的质子数为8,位于第二周期VIA族,故答案为:二;VIA;
(2)氧元素、氟元素电负性很强,水分子之间、氨气分子之间存在氢键,故它们的沸点高于同主族其它元素氢化物,故答案为:氢键;
(3)C为NH3,N原子成3个N-H键,含有1对孤对电子对,杂化轨道数目为4,N原子采取sp3杂化,
与N原子同主族在第四周期的元素为As,As原子核外电子数为33,基态核外电子排布式为[Ar]4s24p3,
故答案为:sp3;[Ar]4s24p3;
(4)晶胞中Xn+的数目为8×
 =1,O2-的数目为12×
=1,O2-的数目为12× =3,故该X的氧化物的化学式为XO3,故答案为:XO3.
=3,故该X的氧化物的化学式为XO3,故答案为:XO3.点评:本题考查无机物的推断、杂化轨道、氢键、核外电子排布规律、晶胞计算等,难度中等,推断元素是解题的关键.

(10分)现有A、B、C、D四种短周期元素(零族除外),请根据信息回答下列问题。
| 元素 | A | B | C | D |
| 性质或结构信息 | 元素非金属性较强,其最高价氧化物对应的水化物为强酸,但其单质稳定,常作保护气。 | 原子核外电子占了4个轨道 | 原子半径仅比氢原子大,其氢化物溶于水形成弱酸 | 原子核外有5种不同能量的电子,且s电子数比p电子数少1个 |
(1)A元素原子的核外电子排布式为: 。
(2)写出C元素的单质与水反应的化学方程式 ;A、C两元素的氢化物的稳定性强弱是 > (用化学式表示)。
(3)D元素最高价氧化物对应的水化物呈 (选填“酸性”、“碱性”或“两性”)。
(4)B元素最简单的氢化物分子为 分子(选填“极性”或“非极性”)。4g该氢化物在空气中完全燃烧生成液态水时,放出222.575kJ热量,写出表示该氢化物燃烧热的热化学方程式 。
(10分)现有A、B、C、D四种短周期元素(零族除外),请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
元素非金属性较强,其最高价氧化物对应的水化物为强酸,但其单质稳定,常作保护气。 |
原子核外电子占了4个轨道 |
原子半径仅比氢原子大,其氢化物溶于水形成弱酸 |
原子核外有5种不同能量的电子,且s电子数比p电子数少1个 |
(1)A元素原子的核外电子排布式为: 。
(2)写出C元素的单质与水反应的化学方程式 ;A、C两元素的氢化物的稳定性强弱是 > (用化学式表示)。
(3)D元素最高价氧化物对应的水化物呈 (选填“酸性”、“碱性”或“两性”)。
(4)B元素最简单的氢化物分子为 分子(选填“极性”或“非极性”)。4g该氢化物在空气中完全燃烧生成液态水时,放出222.575kJ热量,写出表示该氢化物燃烧热的热化学方程式 。
 ,则D为 (填元素符号)。除钙元素外,元素E也与D相邻。则E的单质与水反应的离子方程式为 。
,则D为 (填元素符号)。除钙元素外,元素E也与D相邻。则E的单质与水反应的离子方程式为 。