题目内容
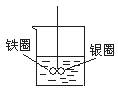
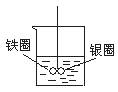
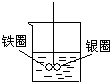 如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液.一段时间后可观察到的现象是( )
如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液.一段时间后可观察到的现象是( )分析:铁圈和银圈连接浸入硫酸铜溶液中,该装置构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,根据正负极上发生的电极反应判断反应现象.
解答:解:A、铁圈和银圈连接浸入硫酸铜溶液中,该装置构成了原电池,较活泼的金属铁作负极,较不活泼的金属作银正极,银圈上铜离子得电子生成铜单质附着在银圈上,故A错误;
B、铁圈和银圈连接浸入硫酸铜溶液构成的原电池中,铁作负极,银正极,银圈上铜离子得电子生成铜单质附着在银圈上,铁电极本身失电子电极质量减轻,不再平衡,故B错误;
C、铁圈和银圈连接浸入硫酸铜溶液构成的原电池中,铁作负极,铁电极本身失电子电极质量减轻,变细,故C正确;
D、铁圈和银圈连接浸入硫酸铜溶液构成的原电池中,铁作负极,银正极,银圈上铜离子得电子生成铜单质附着在银圈上,铁电极本身失电子电极质量减轻,所以银圈向下倾斜,故D正确.
故选CD.
B、铁圈和银圈连接浸入硫酸铜溶液构成的原电池中,铁作负极,银正极,银圈上铜离子得电子生成铜单质附着在银圈上,铁电极本身失电子电极质量减轻,不再平衡,故B错误;
C、铁圈和银圈连接浸入硫酸铜溶液构成的原电池中,铁作负极,铁电极本身失电子电极质量减轻,变细,故C正确;
D、铁圈和银圈连接浸入硫酸铜溶液构成的原电池中,铁作负极,银正极,银圈上铜离子得电子生成铜单质附着在银圈上,铁电极本身失电子电极质量减轻,所以银圈向下倾斜,故D正确.
故选CD.
点评:本题考查了原电池原理,难度不大,解答本题时注意:铁圈、银圈相连和铁圈、银圈不相连的区别.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入硫酸铜溶液,片刻后可观察到的现象是(指悬吊的金属圈)( )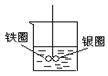
| A.铁圈和银圈左右摇摆不定 | B.保持平衡状态不变 |
| C.铁圈向下倾斜 | D.银圈向下倾斜 |
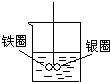 如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液,片刻后可观察到的现象是(指悬吊的金属圈)( )
如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液,片刻后可观察到的现象是(指悬吊的金属圈)( )