题目内容
(16分). 铜是人类最早知道的金属之一,实验室可用C、H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ. 实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
(1)上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气
体是 (填写化学式),产生这种气体的化学方程式为: 。
(2) 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的量为 mol。
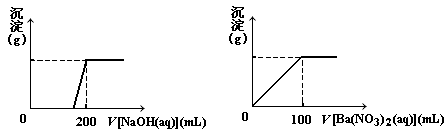
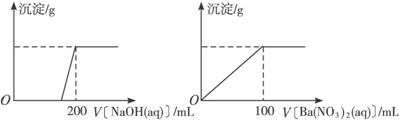
Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
(1) 请通过计算确定m的值;
(2) X的摩尔质量为368 g/mol,请确定X的化学式。
Ⅰ⑴不完全(1分);CO(1分);CO2+C高温2CO 或 CuO+C高温Cu+CO↑ (1分);
⑵ 7.4g,(1分); 0.025 mol(1分)
Ⅱ、⑴ 解:依题意,m g X中:n(Cu)∶n(Fe)=1∶1
2n(Cu2+) +3n(Fe3+) =6.05mol·L-1×0.2L×2-1 mol·L-1×2.12L
故:n (Cu) = n (Fe) = 0.06mol
又,n (S) = 0.6mol·L-1×0.1L×2 = 0.12mol
因此,m g = m(Cu) + m(Fe) + m(S)
= 0.06mol×64g·mol-1+0.06mol×56g·mol-1+0.12mol×32g·mol-1= 11.04g
即m 的值为11.04 (3分)
⑵ 解:设X的化学式为(CuFeS2)n,则
(64+56+32×2)×n = 368 n = 2故X的化学式为Cu2Fe2S4 (3分)
【解析】Ⅰ(1)560ml气体是CO,物质的量是0.025mol。生成CO的方程式是CO2+C高温2CO 或 CuO+C高温Cu+CO↑。沉淀是碳酸钙,物质的量是0.025mol,则生成的CO2也是0.025mol。由于碳的物质的量是0.1mol,所以实验中碳没有完全参加反应。
(2)与碳原子结合的氧原子的物质的量是0.025mol+0.025mol×2=0.075mol,质量是12.g,所以最终固体的质量是8g-1.2g+1.2g-0.6g=7.4g。原氧化铜中氧原子的物质的量是0.1mol,所以剩余氧原子的物质的量是0.1mol-0.075mol=0.025mol,因此含氧化合物的物质的量是0.025mol。
Ⅱ、考查根据方程式及有关图像进行的有关计算。

 阅读快车系列答案
阅读快车系列答案Ⅰ.实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu)∶m(O)=8∶a。当a有不同的取值时,固体混合物成分不同。请分析a的取值范围和固体混合物成分的关系并填入下表(不一定填满,表格不够也可自行增加)。
a的取值范围 | 反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
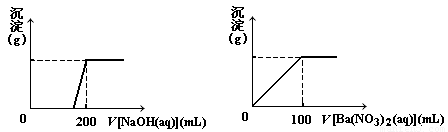
Ⅱ.黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
(1)请通过计算确定m的值;
(2)X的摩尔质量为368 g·mol-1,请确定X的化学式_______________
Ⅰ.实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu)∶m(O)=8∶a。当a有不同的取值时,固体混合物成分不同。请分析a的取值范围和固体混合物成分的关系并填入下表(不一定填满,表格不够也可自行增加):
a的取值范围 | 反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
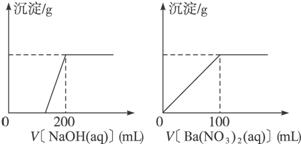
Ⅱ.黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
(1)请通过计算确定m值。
(2)X的摩尔质量为368 g·mol-1,请确定X的化学式。