题目内容
下列过程吸收热量的是( )
A. 液氨汽化 B. 镁条燃烧
C. 氢氧化钠溶于水 D. 氧化钙与水反应
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述I | 陈述Ⅱ |
A | HClO具有强氧化性 | HClO有杀菌消毒作用 |
B | 铝比铁活泼 | 铝比铁更容易被腐蚀 |
C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
D | 浓硝酸具有强氧化性 | 浓硝酸能和浓氨水反应产生白烟 |
A. A B. B C. C D. D
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
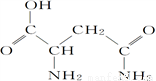
(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
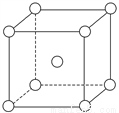
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。
二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示,其总反应的化学方程式为_________。
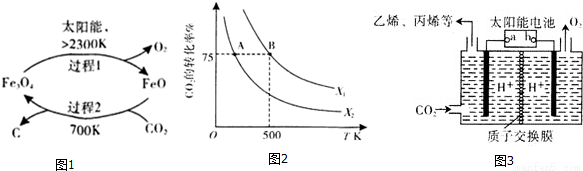
(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和nmol H2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= 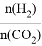 ]的关系如图2所示。
]的关系如图2所示。
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3。
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。


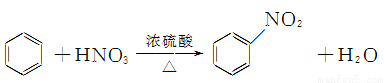
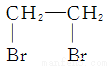
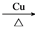 2CH3CHO+2H2O
2CH3CHO+2H2O