题目内容
【题目】甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
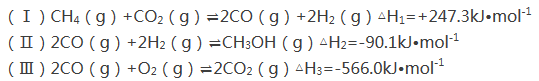
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向容积为4 L的容器通人6 mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为![]() ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。该温度下反应达平衡后,将反应容器的容积增大至10L,平衡向___________(填“正反应”或“逆反应”)方向移动。
【答案】(1)2CH4(g)+O2(g)=2CH3OH(g)△H=—251.6kJ·mol-1
(2)1;33.3﹪ 正反应
【解析】
试题分析:(1)由盖斯定律知(i)×2+(ii)×2+(iii)得到分液2CH4(g)+O2(g)=2CH3OH(g)的△H=(+247.3kJ/mol)×2+(-90.1 kJ/mol)×2+(-566.0 kJ/mol)=-251.6 kJ/mol;
(2)利用三行式:设反应消耗CH4物质的量为n
CH4(g)+C02(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始n/mol 6 6 0 0
变化n/mol n n 2n 2n
平衡n/mol 6-n 6-n 2n 2n
由题意得:2n/(12+2n)=1/4
解得n=2mol
所以K=(12×12)/(1×1)=1
甲烷的转化率为(2/6)×100%=33.3%
该温度下反应达平衡后,将反应容器的容积增大至10L,由于正反应是体积增大的,所以平衡向正反应方向移动。

练习册系列答案
相关题目