题目内容
1—20号中的某几种元素微粒的电子层结构均为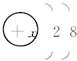 ,根据下列叙述,填写相应的微粒符号:
,根据下列叙述,填写相应的微粒符号:
(1)A微粒一般不与其他物质发生反应,则A为_____________________________。
(2)B微粒所在的元素是地壳中含量最多的,则B为__________________________。
(3)C微粒氧化性很弱,但获得一个电子后形成的电中性的原子则还原性很强,则C为_____。
(4)D微粒与H+相结合形成的化合物,能腐蚀玻璃,则D为____________________。
(1)Ne (2)O2- (3)Na+ (4)F-
解析:
一般不与其他物质发生反应的物质是稀有气体,具有两个电子层的稀有气体原子是Ne;地壳中含量最多的元素是O,O2-具有![]() 的电子层排布;中性原子具有很强的还原性,一般是金属原子,因此C为Na+;能腐蚀玻璃的酸是氢氟酸,所以D为F-。
的电子层排布;中性原子具有很强的还原性,一般是金属原子,因此C为Na+;能腐蚀玻璃的酸是氢氟酸,所以D为F-。

练习册系列答案
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
请回答下列问题:
(1)B的原子结构示意图为 。
(2)F2C和F2E两种化合物中,沸点较高的是 (填化学式),原因是 。
(3)用电子式表示化合物AF3的形成过程 。
(4)G的单质能与H的最高价氧化物的水化物溶液反应,反应的化学方程式为 。
(5)CE2能使酸性高锰酸钾溶液褪色(有Mn2+生成),写出其反应的离子方程式
。
(6)在2L密闭容器中,一定温度下,能说明反应2AE(g)+E2(g)
 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)a. 2V逆(AE)=V正(E2)
b.容器内压强保持不变
c. 容器内密度保持不变
d. 各组分的物质的量浓度相等
e. 混合气体的平均相对分子质量不再改变
(7)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质溶液含HEF。 则该电池的负极的电极反应式为 。
 ,根据下列叙述,填写相应的微粒符号:
,根据下列叙述,填写相应的微粒符号: 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)