题目内容
【题目】常温下,下列关于溶液的说法不正确的是
①加水稀释FeCl3溶液,c(Fe3+)/c(Cl-)的值减小
②浓度均为0.1 mol·L-l的Na2CO3和Na2HCO3的混合溶液中:2c(Na+)=3[c(CO32- )+c(HCO3-)]
③向0.1 mol/L的氨水中滴加等浓度的盐酸,恰好中和时溶液的pH=a,则溶液中由水电离产生的c(OH-) = 10-amol·L-1
④pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合.反应后所得溶液中: c(CH3COOH)>c(CH3COO-)>c(Na+)
⑤Na2S 稀溶液中:c(OH-) =c(H+)+c( H2S)+c( HS-)
A. ②⑤ B. ①②⑤ C. ②③④⑤ D. ①②⑤
【答案】A
【解析】①加水稀释FeCl3溶液,促进Fe3+水解使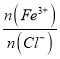 减小,所以
减小,所以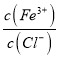 的值减小,故①正确;②浓度均为0.1 mol·L-l的Na2CO3和NaHCO3的混合溶液中:碳原子以CO32-、HCO3-、H2CO3形式存在,根据物料守恒得,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故②错误;③向0.1 mol L-1的氨水中滴加等浓度的盐酸,恰好中和时生成NH4Cl,H+和OH-都是由水电离产生的,pH=a,则c(H+)=10-a mol L-1,所以由水电离产生的c(OH-)= c(H+)=10-a mol L-1,故③正确;④醋酸是弱酸,常温下pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合反应,醋酸过量较多,c(CH3COOH)最大,溶液显酸性,c(H+)> c(OH-),由电荷守恒得:c(CH3COO-)>c(Na+),故④正确;⑤Na2S 稀溶液中存在S2-+H2O
的值减小,故①正确;②浓度均为0.1 mol·L-l的Na2CO3和NaHCO3的混合溶液中:碳原子以CO32-、HCO3-、H2CO3形式存在,根据物料守恒得,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故②错误;③向0.1 mol L-1的氨水中滴加等浓度的盐酸,恰好中和时生成NH4Cl,H+和OH-都是由水电离产生的,pH=a,则c(H+)=10-a mol L-1,所以由水电离产生的c(OH-)= c(H+)=10-a mol L-1,故③正确;④醋酸是弱酸,常温下pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合反应,醋酸过量较多,c(CH3COOH)最大,溶液显酸性,c(H+)> c(OH-),由电荷守恒得:c(CH3COO-)>c(Na+),故④正确;⑤Na2S 稀溶液中存在S2-+H2O![]() HS-+OH-、HS-+ H2O
HS-+OH-、HS-+ H2O![]() H2S+ OH-,由质子守恒得:c(OH-)=c(H+)+2c(H2S)+c(HS-),故⑤错误。综上,②⑤错误,选A。
H2S+ OH-,由质子守恒得:c(OH-)=c(H+)+2c(H2S)+c(HS-),故⑤错误。综上,②⑤错误,选A。

 口算能手系列答案
口算能手系列答案