题目内容
在1.5L的密闭容器中通入2mol N2和3mol H2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数为
- A.0.34
- B.0.64
- C.0.44
- D.0.54
C
氮气和氢气反应的方程式为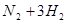 ==
== ,相同条件下气体的压强之比=物质的量之比,所以,反应后混合气体的总物质的量为4mol,则
,相同条件下气体的压强之比=物质的量之比,所以,反应后混合气体的总物质的量为4mol,则
由反应方程式![]() ==
==![]() ,设氮气的物质的量变化为xmol,得
,设氮气的物质的量变化为xmol,得
起始物质的量2mol 3mol 0
变化物质的量 x 3x 2x
平衡物质的量 2-x 3-3x 2x
解得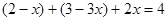 ,
, ;所以平衡后
;所以平衡后 ,
,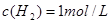 ,
, ;
;
氮气和氢气反应的方程式为
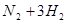 ==
== ,相同条件下气体的压强之比=物质的量之比,所以,反应后混合气体的总物质的量为4mol,则
,相同条件下气体的压强之比=物质的量之比,所以,反应后混合气体的总物质的量为4mol,则由反应方程式
起始物质的量2mol 3mol 0
变化物质的量 x 3x 2x
平衡物质的量 2-x 3-3x 2x
解得
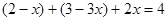 ,
, ;所以平衡后
;所以平衡后 ,
,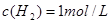 ,
, ;
;

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定条件下发生反应.达到平衡时,容器内压强为反应开始时的0.8倍,则该反应的化学平衡常数为( )
| A、0.34 | B、0.64 | C、0.44 | D、0.54 |
在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数为( )
| A.0.34 | B.0.64 | C.0.44 | D.0.54 |