题目内容
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的加NaOH溶液箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得加NaOH溶液箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
解析 (1)①2Na+2H2O===2NaOH+H2↑
②Na2O+H2O===2NaOH
③2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(2)n(Al)=![]() =0.010 mol
=0.010 mol
根据反应③可得由加NaOH溶液消耗NaOH的物质的量为n(NaOH)=0.010 mol
生成的氢气的物质的量为n(H2)=0.015 mol
那么由金属钠生成的氢气的物质的量为
n(H2)=![]() -0.015 mol=0.035 mol
-0.015 mol=0.035 mol
根据反应①可得金属钠的物质的量为n(Na)=2×0.035 mol=0.070 mol
又因为反应后溶液中的NaOH的物质的量为
n(NaOH)=2.0 L×0.050 mol·L-1=0.10 mol
所以溶液中Na+的总物质的量即原金属钠的总物质的量为
n(Na+)=0.10 mol+0.010 mol=0.11 mol
n(Na2O)=![]() =0.020 mol
=0.020 mol
该钠块中钠元素的质量分数为:
![]() ×100%≈89%
×100%≈89%
答案 (1)①2Na+2H2O===2NaOH+H2↑
②Na2O+H2O===2NaOH
③2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(2)89%

练习册系列答案
相关题目
天然气是植物残体在隔绝空气的条件下,经过微生物的发酵作用而逐渐形成的,因此天然气中所贮藏的化学能最初来自于( )
| A、化学能 | B、生物质能 | C、太阳能 | D、地热能 |
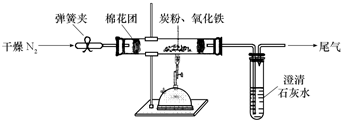


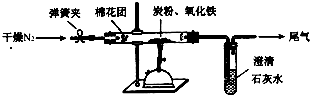 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.