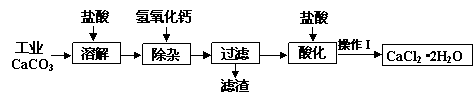
题目内容
下列物质之间的转化必须加入还原剂才能实现的是
- A.CO32-→CO2
- B.Cl2→ClO-
- C.Na→Na+
- D.HNO3→NO
D
分析:元素的化合价降低说明该元素被还原,发生了还原反应,必须加入还原剂才能实现.
解答:A、没有元素化合价的变化,不是氧化还原反应,故A错误;
B、氯元素的化合价从0价升高到了+1价,必须加入氧化剂才能实现,故B错误;
C、钠元素的化合价从0价升高到了+1价,必须加入氧化剂才能实现,故C错误;
D、氮元素的化合价从+5价降到了+2价,必须加入还原剂才能实现,故D正确.
故选D.
点评:本题考查氧化还原反应的特征和有关的概念内涵,要求学生具有分析和解决问题的能力,难度不大.
分析:元素的化合价降低说明该元素被还原,发生了还原反应,必须加入还原剂才能实现.
解答:A、没有元素化合价的变化,不是氧化还原反应,故A错误;
B、氯元素的化合价从0价升高到了+1价,必须加入氧化剂才能实现,故B错误;
C、钠元素的化合价从0价升高到了+1价,必须加入氧化剂才能实现,故C错误;
D、氮元素的化合价从+5价降到了+2价,必须加入还原剂才能实现,故D正确.
故选D.
点评:本题考查氧化还原反应的特征和有关的概念内涵,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是______.
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为______.
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
| ______ | ______ |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:______.
实验3:进行实验以确定可能的原因.
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因:______.
 已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是
已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是