题目内容
在反应H2S+H2SO4=S↓+SO2↑+2H2O中,若有32g硫生成则转移电子为( )
| A.6mol | B.2mol | C.3mol | D.4mol |
n(S)=
=1mol,
在反应H2S+H2SO4=S↓+SO2↑+2H2O中,H2S→S,H2SO4→SO2,S的化合价变化值都为2,则
由方程式可知,生成1molS,转移的电子的物质的量为2mol,
故选B.
| 32g |
| 32g/mol |
在反应H2S+H2SO4=S↓+SO2↑+2H2O中,H2S→S,H2SO4→SO2,S的化合价变化值都为2,则
由方程式可知,生成1molS,转移的电子的物质的量为2mol,
故选B.

练习册系列答案
相关题目
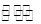 2NH3达到平衡时的c
(NH3)与c (N2)
2NH3达到平衡时的c
(NH3)与c (N2)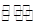 2NH3达到平衡时的c(NH3)与c (N2)
2NH3达到平衡时的c(NH3)与c (N2)