题目内容
11.下列说法正确的是( )| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 只要含有离子键的化合物就是离子化合物 |
分析 A.离子键是阴阳离子间的静电作用(引力和斥力);
B.元素的非金属性越强,对应的氢化物的还原性越弱;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.离子键只存在于离子化合物中.
解答 解:A.形成离子键的阴阳离子间存在静电吸引力和静电斥力,故A错误;
B.元素的非金属性越强,对应的氢化物的还原性越弱,HF、HCl、HBr、HI的还原性逐渐增强,故B错误;
C.第三周期非金属元素的非金属从左到右逐渐增强,最高价氧化物对应水化物的酸性也逐渐增强,而含氧酸的酸性无此规律,故C错误;
D.离子键只存在于离子化合物中,则只要含有离子键的化合物就是离子化合物,故D正确.
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
3.下列反应或操作会明显产生吸热现象的是( )
| A. | 将氢氧化钠溶液迅速倒入盛有盐酸的量热计中 | |
| B. | 浓硫酸加水稀释 | |
| C. | 氯化铵固体和氢氧化钡固体在烧杯中混合搅拌 | |
| D. | 甲烷的燃烧 |
2.下列关于苯的说法中,正确的是( )
| A. | 苯的分子式是C6H6,不能使酸性高锰酸钾溶液褪色,属于饱和烃 | |
| B. | 从苯的凯库勒式看,分子中含有双键,所以苯属于烯烃 | |
| C. | 在催化剂作用下,苯与液溴发生取代反应生成溴苯 | |
| D. | 苯泄露会导致苯溶入水中,渗入土壤,对周边农田、水源造成严重的污染 |
19.根据下列实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加盐酸 | 有白色胶状沉淀生成 | 非金属性:Cl>Si |
| B | 向MnO2中滴入浓盐酸 | 有黄绿色气体产生 | 氧化性:MnO2>Cl2 |
| C | 向A溶液中滴加硝酸,再滴加KSCN溶液 | 溶液变成红色 | A溶液中一定有Fe3+ |
| D | 向鸡蛋白溶液中滴入HgCl2溶液 | 有白色沉淀 | 蛋白质发生盐析 |
| A. | A | B. | B | C. | C | D. | D |
6.下列各有机物的分类或命名不正确的是( )
| A. |  对甲基苯酚,属于芳香化合物 | B. |  3-甲基戊烷,属于烷烃 | ||
| C. |  2-甲基-1-丙醇,属于一元醇 | D. |  3-甲基-1-丁烯,属于脂肪烃 |
16.枸椽酸乙胺嗪可用于驱除肠道虫病,其结构简式为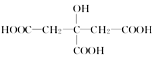 ,下列物质中不能与枸椽酸乙胺嗪反应的是( )
,下列物质中不能与枸椽酸乙胺嗪反应的是( )
 ,下列物质中不能与枸椽酸乙胺嗪反应的是( )
,下列物质中不能与枸椽酸乙胺嗪反应的是( )| A. | 乙酸 | B. | 乙醇 | C. | 溴的苯溶液 | D. | 氢氧化钠溶液 |
20.化学在生产和日常生活中有着重要应用.下列说法不正确的是( )
| A. | 施肥时,草木灰(有效成份K2CO3)不能与NH4Cl混合使用 | |
| B. | 热的纯碱能去厨房油污是因为其水解呈碱性,可以使油脂水解成水溶性物质 | |
| C. | 在服用胃舒平(主要成分有氢氧化铝)期间可以食用醋、可乐等食品 | |
| D. | 使用含氟牙膏预防龋齿利用了沉淀转化的原理 |
 的合成路线如下:
的合成路线如下:
 .
. .
. (填结构简式).
(填结构简式). 的合成路线.
的合成路线.