题目内容
A、B、C三种元素,已知5.75g A单质跟盐酸完全反应,在标准状况下可产生氢气2.8L和ACln 0.25mol;B的气态氢化物化学式为H2B,其相对分子质量与B的最高价氧化物对应的水化物相对分子质量之比为1:2.88,B的核内质子数与中子数相等;C元素原子的相对原子质量与原子序数之比约为2:1,C和B生成CB2,后者能溶解B单质。试回答:
(1)A、B、C的名称分别是________、________、________,A的离子结构示意图是____ ___ _,B的原子结构示意图是_____ ___,CB2的化学式是________。
(2)A与B形成化合物的化学方程式是________。
解析:
(1)钠 硫 碳, (2)2Na+S
|
提示:
本题主要考查原子组成、校外电子排布、元素周期律等知识,以及这些知识的综合应用。 ①因为A+nHCl=ACln+ 则M(A)= ②因为B的气态氢化物为H2B,则其最高正价为+6价,因此最高价氧化物对应水化物的化学式为H2BO4设B的质量数为X. 则由题意知: ③因为C和硫生成外CB2,硫为-2价,则C为+4价,又因CB2是可溶解硫的溶剂,及C原子相对原子质量与原子序数之比为2:1,故C为碳。 解题关键是要应用题中给出的三个条件:①A单质与盐酸反应;②B元素的气态氢化物和最高价氧化物对应的水化物的相对分子质量比以及B的质子数、中子数相等;③C元素原子电子层结构特点。解题时,要根据有关化学反应方程式和化学式的推算或推理结果,应用原子电子层结构的规律来推断。
|

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案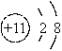 ,
, 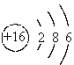 ,CS2
,CS2  已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的 A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体.
A、B、C三种非金属元素的质子数之和为16,它们的单质在一定条件下两两化合可以生成三种常见的化合物D、E、F.D、F的一个分子中只含有10个电子,常温下D是一种液体,E是一种无色的气体.