题目内容
(18分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶,制备它的一种配方中含有下列三种物质
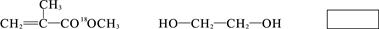
甲 乙 丙
(1)下列试剂能与甲反应而褪色的是(填序号) 。
①溴的CCl4溶液 ②酸性KMnO4溶液 ③石蕊试液 ④含酚酞的烧碱溶液 ⑤FeCl3溶液
写出由甲在稀硫酸作用下水解的化学反应方程式:
(2)乙可以由淀粉通过下列转化制得(其中A、B、C、D均为有机物):
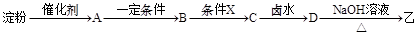
i.上述转化过程中涉及的条件X是 。
ii.物质A常用新制Cu(OH)2来检验,其主要的反应原理用化学方程式可表示为:
iii.上述转化过程中属于水解反应类型的有 个。
iv.D是一种液态卤代烃,已知其密度为ρ g/cm3为测定其相对分子质量,拟实验步骤如下:
第一步:准确量取该卤代烃V mL;
第二步:在锥形瓶中加入过量的稀NaOH溶液,塞上连有长玻璃管的塞子,加热;
第三步:反应完成后冷却溶液,加稀HNO3酸化;
第四步:滴加过量AgNO3溶液得浅黄色沉淀;
第五步:过滤,洗涤,干燥称重得固体m克。请回答:
a.该卤代烃中所含官能团的名称是 。
b.该卤代烃的相对分子质量用含ρ、V、m的代数式可表示为 。
c.如果在第三步中加入稀HNO3的量不足,则测得相对分子质量将 (填“偏大”,“偏小”或“无影响”)。
d.写出D→乙的化学反应方程式:
(3)化合物丙中含氧为29.09%,相对分子质量不超过120,在空气中完全燃烧时,只生成CO2和H2O,经实验检测得知丙还具有下列结构和性质特点:
①核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2;
②与FeCl3溶液作用显紫色。
写出丙与Na2CO3反应的化学方程式:
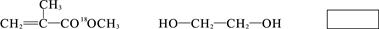
甲 乙 丙
(1)下列试剂能与甲反应而褪色的是(填序号) 。
①溴的CCl4溶液 ②酸性KMnO4溶液 ③石蕊试液 ④含酚酞的烧碱溶液 ⑤FeCl3溶液
写出由甲在稀硫酸作用下水解的化学反应方程式:
(2)乙可以由淀粉通过下列转化制得(其中A、B、C、D均为有机物):
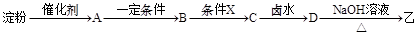
i.上述转化过程中涉及的条件X是 。
ii.物质A常用新制Cu(OH)2来检验,其主要的反应原理用化学方程式可表示为:
iii.上述转化过程中属于水解反应类型的有 个。
iv.D是一种液态卤代烃,已知其密度为ρ g/cm3为测定其相对分子质量,拟实验步骤如下:
第一步:准确量取该卤代烃V mL;
第二步:在锥形瓶中加入过量的稀NaOH溶液,塞上连有长玻璃管的塞子,加热;
第三步:反应完成后冷却溶液,加稀HNO3酸化;
第四步:滴加过量AgNO3溶液得浅黄色沉淀;
第五步:过滤,洗涤,干燥称重得固体m克。请回答:
a.该卤代烃中所含官能团的名称是 。
b.该卤代烃的相对分子质量用含ρ、V、m的代数式可表示为 。
c.如果在第三步中加入稀HNO3的量不足,则测得相对分子质量将 (填“偏大”,“偏小”或“无影响”)。
d.写出D→乙的化学反应方程式:
(3)化合物丙中含氧为29.09%,相对分子质量不超过120,在空气中完全燃烧时,只生成CO2和H2O,经实验检测得知丙还具有下列结构和性质特点:
①核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2;
②与FeCl3溶液作用显紫色。
写出丙与Na2CO3反应的化学方程式:
(1)①②④ 
(2)i.浓H2SO4 170℃
ii.
iii.2 iv.a 溴原子 b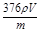 c 偏小
c 偏小
d CH2Br—CH2Br + 2NaOH HO—CH2—CH2—OH + 2NaBr
HO—CH2—CH2—OH + 2NaBr
(3)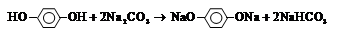

(2)i.浓H2SO4 170℃
ii.

iii.2 iv.a 溴原子 b
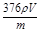 c 偏小
c 偏小d CH2Br—CH2Br + 2NaOH
 HO—CH2—CH2—OH + 2NaBr
HO—CH2—CH2—OH + 2NaBr(3)
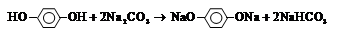
(1)甲中含有碳碳双键和酯基,所以①②分别发生加成反应和氧化反应而褪色。④发生水解反应也褪色,答案选①②④。酯化反应中羧酸提供羟基,醇提供氢原子,所以水解反应的方程式为 。
。
(2)①乙是乙二醇,则D是1,2-二卤乙烷,C就是乙烯。因为淀粉水解生成葡萄糖,葡萄糖分解得到乙醇,乙醇消去反应就生成乙烯。所以条件X是浓H2SO4、170℃。
②葡萄糖含有醛基,能被新制备的氢氧化铜悬浊液氧化,反应式为
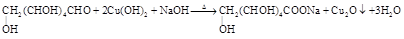 。
。
③淀粉和卤代烃都发生的是水解反应,共2个。
④滴加过量AgNO3溶液得浅黄色沉淀,说明是溴化银沉淀,因此含有的官能团是溴原子。溴化银的物质的量是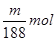 ,则卤代烃的物质的量是
,则卤代烃的物质的量是 ,所以该卤代烃的相对分子质量为
,所以该卤代烃的相对分子质量为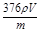 。如果硝酸不足,则产生的沉淀质量就偏大,所以测定结果就偏低。
。如果硝酸不足,则产生的沉淀质量就偏大,所以测定结果就偏低。
(3)与FeCl3溶液作用显紫色,说明含有酚羟基。根据含氧量可知,分子中最多含有的氧原子数是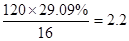 。又因为核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2,这说明苯环上有2个酚羟基,且是对位的关系。酚羟基的酸性强于碳酸氢钠的,而小于碳酸的,所以丙和碳酸钠反应的方程式为
。又因为核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2,这说明苯环上有2个酚羟基,且是对位的关系。酚羟基的酸性强于碳酸氢钠的,而小于碳酸的,所以丙和碳酸钠反应的方程式为
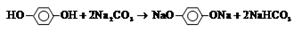 。
。
 。
。(2)①乙是乙二醇,则D是1,2-二卤乙烷,C就是乙烯。因为淀粉水解生成葡萄糖,葡萄糖分解得到乙醇,乙醇消去反应就生成乙烯。所以条件X是浓H2SO4、170℃。
②葡萄糖含有醛基,能被新制备的氢氧化铜悬浊液氧化,反应式为
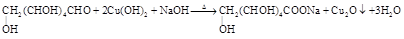 。
。③淀粉和卤代烃都发生的是水解反应,共2个。
④滴加过量AgNO3溶液得浅黄色沉淀,说明是溴化银沉淀,因此含有的官能团是溴原子。溴化银的物质的量是
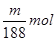 ,则卤代烃的物质的量是
,则卤代烃的物质的量是 ,所以该卤代烃的相对分子质量为
,所以该卤代烃的相对分子质量为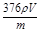 。如果硝酸不足,则产生的沉淀质量就偏大,所以测定结果就偏低。
。如果硝酸不足,则产生的沉淀质量就偏大,所以测定结果就偏低。(3)与FeCl3溶液作用显紫色,说明含有酚羟基。根据含氧量可知,分子中最多含有的氧原子数是
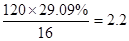 。又因为核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2,这说明苯环上有2个酚羟基,且是对位的关系。酚羟基的酸性强于碳酸氢钠的,而小于碳酸的,所以丙和碳酸钠反应的方程式为
。又因为核磁共振氢谱检测只有两种吸收峰,且峰面积之比1∶2,这说明苯环上有2个酚羟基,且是对位的关系。酚羟基的酸性强于碳酸氢钠的,而小于碳酸的,所以丙和碳酸钠反应的方程式为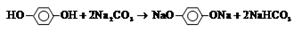 。
。
练习册系列答案
相关题目
 与
与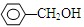
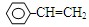 与CH3—CH=CH2
与CH3—CH=CH2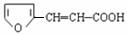 有多种同分异构体,符合下列要求的有________种。
有多种同分异构体,符合下列要求的有________种。