题目内容
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实验。设计了如下图所示装置进行实验.已知:1.0 mol/L的Fe(NO3)3溶液的pH=1

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)实验前鼓入N2的目的是 。
(3)装置B中产生了白色沉淀,其成分是_______,说明SO2具有____性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是 。
②按观点2,装置B中反应的离子方程式是 。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号) 。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)实验前鼓入N2的目的是 。
(3)装置B中产生了白色沉淀,其成分是_______,说明SO2具有____性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是 。
②按观点2,装置B中反应的离子方程式是 。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号) 。
| A.1 mol/L稀硝酸 |
| B.1.5 mol/L Fe(NO3)2溶液 |
| C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
| D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
(1)分液漏斗
(2)排净装置中的空气,防止溶液中的SO2被空气中的氧气氧化,干扰实验。
(3)BaSO4 还原
(4)①静置一段时间后,溶液由棕黄色变成浅绿色
②3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ ③ C
(2)排净装置中的空气,防止溶液中的SO2被空气中的氧气氧化,干扰实验。
(3)BaSO4 还原
(4)①静置一段时间后,溶液由棕黄色变成浅绿色
②3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ ③ C
(2)反应前在通入N2,排除装置A中的空气,防止对实验干扰;
(3)硝酸具有强氧化性,白色沉淀是BaSO4,则说明二氧化硫具有还原性;
(4)分析各个观点,观点1是Fe3+把二氧化硫氧化,反应原理是,
2Fe3++SO2+Bs2++2H2O=2Fe2++BaSO4+4H+;Fe(NO3)3中含有Fe3+,A错;NO3?在酸性条件下有氧化性,B错;选C。
(3)硝酸具有强氧化性,白色沉淀是BaSO4,则说明二氧化硫具有还原性;
(4)分析各个观点,观点1是Fe3+把二氧化硫氧化,反应原理是,
2Fe3++SO2+Bs2++2H2O=2Fe2++BaSO4+4H+;Fe(NO3)3中含有Fe3+,A错;NO3?在酸性条件下有氧化性,B错;选C。

练习册系列答案
相关题目



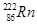 ,其原子中的质子数为136
,其原子中的质子数为136





