题目内容
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为___________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_______________。
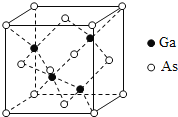
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。
【答案】[Ar]3d104s24p3大于小于三角锥形sp3GaF3为离子晶体,GaCl3为分子晶体原子晶体共价
【解析】
(1)根据核外电子排布规律,基态As原子的核外电子排布式为[Ar]3d104s24p3。
(2)根据元素周期律,Ga和As为同一周期的两种元素,且Ga的原子序数小于As,因此原子半径Ga大于As,第一电离能Ga小于As。
(3)AsCl3分子中砷原子价电子有4对,其中3个成键电子对、1个孤电子对,因此其分子的立体构型为三角锥形,As的杂化轨道类型为sp3杂化。
(4)由题意可知GaF3的熔点远远高于GaCl3,其原因为GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3熔沸点更高。
(5)GaAs晶体的熔点很高,可以判断该晶体类型为原子晶体;Ga与As以极性共价键键合。

【题目】下表中物质分类组合完全正确的是( )
A | B | C | D | |
酸 | HCl | H2SO4 | NaHSO4 | HNO3 |
碱 | Na2CO3 | NaOH | Fe(OH)3 | KOH |
盐 | CuSO4 | BaSO4 | NaCl | NaHCO3 |
氧化物 | H2O | KClO3 | CuO | Na2O |
A.AB.BC.CD.D