题目内容
【题目】醋酸溶液中存在电离平衡:CH3COOHCH3COO﹣+H+ , 下列叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH﹣)+c(CH3COO ̄)
B.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH=7
C.CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动
D.室温下向pH=3的醋酸溶液中加水稀释,溶液中 ![]() 不变
不变
【答案】B
【解析】解:A.醋酸中氢离子由醋酸和水电离,根据质子守恒可知,c(H+)=c(OH﹣)+c(CH3COO),故A正确;
B.常温下,pH=2的CH3COOH溶液中醋酸的浓度大于0.01mol/L,pH=12的NaOH溶液中NaOH的浓度为0.01mol/L,二者等体积混合,醋酸过量,混合后溶液显酸性,pH小于7,故B错误;
C.CH3COOH溶液中加入少量CH3COONa固体,醋酸根离子浓度增大,电离平衡逆向移动,故C正确;
D.室温下向pH=3的醋酸溶液中加水稀释,溶液中 ![]() =
= ![]() ,Kh为常数,所以温度不变,溶液中
,Kh为常数,所以温度不变,溶液中 ![]() 不变,故D正确.
不变,故D正确.
故选B.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
(1)已知反应N2O4(g)2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有 .
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
(2)用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g).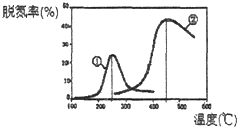
①该反应的△S0(填“>”、“=”或“<”).
②以下说法正确的是 .
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.
已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式: .
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)= .
②T1T2(填“>”或“<”,下空同);判断理由是 .
③T1℃时,反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)平衡常数K=
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 达新平衡时CH4的转化率将 (填“增大”、“减小”或“不变”).
【题目】反应①Fe(s)+CO2(g)FeO(s)+CO(g)△H1=akJmol﹣1 , 平衡常数为K;反应②CO(g)+ ![]() O2(g)CO2(g)△H2=bkJmol﹣1 . 测得在不同温度下,K值如表:
O2(g)CO2(g)△H2=bkJmol﹣1 . 测得在不同温度下,K值如表:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2起始浓度为2mol/L,CO的平衡浓度为 .
(2)反应①中的a0(填“大于”、“小于”或“等于”).
(3)700℃时反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有(填序号).
A.缩小反应器体积
B.通入CO2
C.升高温度到 900℃
D.使用合适的催化剂
(4)如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).
(5)反应③2Fe(s)+O2(g)═2FeO(s)△H3= .

