题目内容
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
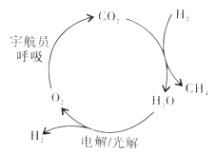
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
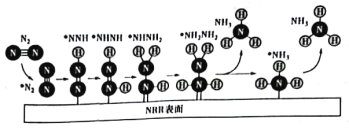
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。
②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)
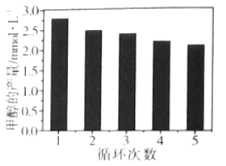
【答案】② ④ H2 Co4N/Al2O3 减小 气体流速加快,导致反应物与催化剂接触时间不够 360℃ 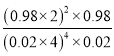 反应产生的甲酸腐蚀催化剂,使催化剂活性降低
反应产生的甲酸腐蚀催化剂,使催化剂活性降低
【解析】
(1)自由能越小,反应越容易发生,反应的焓变不随温度变化而发生变化,反应的自由能与温度有关,上述反应的自由能所处温度相同,反应①②的自由能均大于0,且二者自由能相等,反应②在反应过程中吸收的能量较反应①多,因此反应②更难发生,反应进行程度最小;反应③④的自由能均小于0,反应④在反应过程中放出的能量较反应③多,因此反应④更易发生,反应进行程度最大;
(2)①该过程中发生反应:CO2+4H2![]() CH4+2H2O、2H2O
CH4+2H2O、2H2O![]() 2H2+O2,由反应方程式可知,需要不断补充H2;
2H2+O2,由反应方程式可知,需要不断补充H2;
②由表格数据可知,Co4N/Al2O3作催化剂时,CO2转化率较高,因此Co4N/Al2O3催化性能更好;
③由表格数据可知,在相同温度下,随着气体流速增加,CO2的转化率逐渐减小;其可能的原因是:气流速度过快时,通入的气体不能及时发生反应,使得反应物的转化率较低;
④气体流速为10mL/min时,当温度为340℃时,CO2的转化率为98%,温度为360℃时,CO2的转化率为98%,该反应温度升高的过程中,CO2的转化率逐渐增加,但340℃~360℃过程中,温度在发生变化,而这两个时刻CO2的转化率相同,说明在温度为340℃~360℃过程中一定存在CO2的转化率最大值,在达到转化率最大值后,升高温度,平衡逆向移动,因此最可能达到化学平衡状态的温度是360℃;
设n(H2)=4mol,则n(CO2)=1mol,在360℃下达到平衡时,CO2的转化率为98%,则
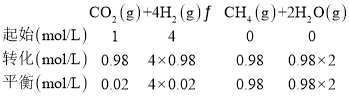
平衡常数为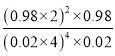 ;
;
(3)在Co/C作为催化剂时,反应后可以得到的产物中含有少量甲酸,甲酸属于一元弱酸,能够与Co发生反应,使催化剂的活性降低。

【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中6种元素的相关信息,其中Q、W、X位于同一周期。
元素 | 信息 |
Q | 单质是稳定的半导体材料,用于制造芯片 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色反应为紫色(透过蓝色钴玻璃片) |
Z | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
M | 原子结构示意图为 |
(1)Q元素所在周期表的位置为_____。
(2)W单质的电子式为_____。
(3)Z的单质与X的最高价氧化物对应的水化物反应的离子方程式为_____。
(4)Y的金属性强于X,请结合原子结构解释其原因_____。
(5)下列对于M及其化合物的推断中,正确的是_____(填序号)。
①M的最低负化合价与W的最低负化合价相同
②M的氢化物的稳定性弱于W的氢化物的稳定性
③M的单质可与X和W形成的化合物的水溶液发生置换反应
(6)与M位于同一主族,电子层数比M多一层的元素在生活中的用途是_____(写出一条即可)。