题目内容
图中,A、G是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,D、F、M为单质,I、L是正四面体结构的非极性分子,I是一种重要的能源,产物J是含B金属元素的胶状白色沉淀,K是由含B、D两种元素组成的化合物,N是淡黄色固体(图中部分反应物或生成物没有列出).
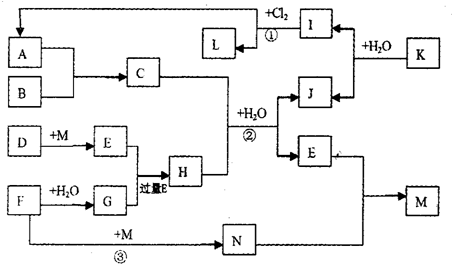
请按要求回答:
(1)元素B在元素周期表中的位置是 (填第几周期第几族).写出K的化学式 ,L的电子式 .
(2)反应①进行的条件是 .
(3)反应②的离子方程式为 .
(4)反应③的化学方程式为 .
(5)写出Si与G溶液反应的离子方程式 .

请按要求回答:
(1)元素B在元素周期表中的位置是
(2)反应①进行的条件是
(3)反应②的离子方程式为
(4)反应③的化学方程式为
(5)写出Si与G溶液反应的离子方程式
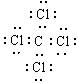
分析:I、L是正四面体结构的非极性分子,I是一种重要的能源,应为甲烷,则L为CCl4,其电子式为 ,
,
则A为HCl,产物J是含B金属元素的胶状白色沉淀,应为Al(OH)3,则B为Al,则C为AlCl3,
K能水解生成甲烷和Al(OH)3,应为Al4C3,
N是淡黄色固体,应为Na2O2,则M为O2,F为Na,G为NaOH,D为C,E为CO2,H为NaHCO3,结合对应物质的性质以及题目要求解答该题.
 ,
,则A为HCl,产物J是含B金属元素的胶状白色沉淀,应为Al(OH)3,则B为Al,则C为AlCl3,
K能水解生成甲烷和Al(OH)3,应为Al4C3,
N是淡黄色固体,应为Na2O2,则M为O2,F为Na,G为NaOH,D为C,E为CO2,H为NaHCO3,结合对应物质的性质以及题目要求解答该题.
解答:解:I、L是正四面体结构的非极性分子,I是一种重要的能源,应为甲烷,则L为CCl4,其电子式为 ,
,
则A为HCl,产物J是含B金属元素的胶状白色沉淀,应为Al(OH)3,则B为Al,则C为AlCl3,
K能水解生成甲烷和Al(OH)3,应为Al4C3,
N是淡黄色固体,应为Na2O2,则M为O2,F为Na,G为NaOH,D为C,E为CO2,H为NaHCO3,
(1)B为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第三周期第ⅢA族,K为Al4C3,L为CCl4,其电子式为 ,
,
故答案为:第三周期第ⅢA族;Al4C3; ;
;
(2)反应①为甲烷与氯气的反应,应在光照条件下反应,且氯气过量,否则可能生成多种氯代烃,
故答案为:光照、过量Cl2;
(3)反应②为AlCl3和NaHCO3的互促水解反应,反应的离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(4)反应③为钠与氧气生成过氧化钠的反应,反应的方程式为2Na+O2
Na2O2,
故答案为:2Na+O2
Na2O2;
(5)Si与NaOH溶液反应的离子方程式为Si+2OH-+H2O═SiO32-+2H2↑,
故答案为:Si+2OH-+H2O═SiO32-+2H2↑.
 ,
,则A为HCl,产物J是含B金属元素的胶状白色沉淀,应为Al(OH)3,则B为Al,则C为AlCl3,
K能水解生成甲烷和Al(OH)3,应为Al4C3,
N是淡黄色固体,应为Na2O2,则M为O2,F为Na,G为NaOH,D为C,E为CO2,H为NaHCO3,
(1)B为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第三周期第ⅢA族,K为Al4C3,L为CCl4,其电子式为
 ,
,故答案为:第三周期第ⅢA族;Al4C3;
 ;
;(2)反应①为甲烷与氯气的反应,应在光照条件下反应,且氯气过量,否则可能生成多种氯代烃,
故答案为:光照、过量Cl2;
(3)反应②为AlCl3和NaHCO3的互促水解反应,反应的离子方程式为Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(4)反应③为钠与氧气生成过氧化钠的反应,反应的方程式为2Na+O2
| ||
故答案为:2Na+O2
| ||
(5)Si与NaOH溶液反应的离子方程式为Si+2OH-+H2O═SiO32-+2H2↑,
故答案为:Si+2OH-+H2O═SiO32-+2H2↑.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和综合运用元素化合物知识的考查,明确推断中转化的关系及物质的性质即可解答,明确推断突破口为I、K及N是淡黄色固体是解答本题的关键.

练习册系列答案
相关题目
 (1)写出B的化学式______________,
(1)写出B的化学式______________,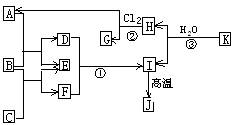 请按要求回答:
请按要求回答: