题目内容
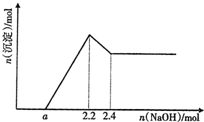 现有SiO2、Fe2O3和Al2O3的混合物共42.2g,向其中加入2.0L一定浓度的盐酸,充分反应后过滤,再向滤液中滴加NaOH溶液.在滴加的过程中,产生沉淀的物质的量和加入NaOH的物质的量关系如图所示.求:
现有SiO2、Fe2O3和Al2O3的混合物共42.2g,向其中加入2.0L一定浓度的盐酸,充分反应后过滤,再向滤液中滴加NaOH溶液.在滴加的过程中,产生沉淀的物质的量和加入NaOH的物质的量关系如图所示.求:(1)所用盐酸的物质的量浓度;
(2)混合物中Al2O3的质量;
(3)a的取值范围为多少?
分析:由图象可知,向滤液中加入NaOH溶液,没有沉淀生成,说明盐酸有剩余,继续加入NaOH溶液,当加入氢氧化钠共2.2时,沉淀量最大,此时溶液溶质为氯化钠,根据钠元素、氯离子守恒有n(HCl)=n(NaCl)=n(NaOH),再根据c=
计算原盐酸物质的量浓度.根据氢氧化铝沉淀全部溶解消耗氢氧化钠的量可以计算氢氧化铝的量,根据元素守恒可以确定混合物中氧化铝的质量.
| n |
| V |
解答:解:(1)当加入氢氧化钠共2.2mol时,沉淀量最大,此时溶液溶质为氯化钠,根据钠元素、氯离子守恒有n(HCl)=n(NaCl)=n(NaOH)=2.2mol,所以n(HCl)=2.2mol,故原盐酸物质的量浓度为
=1.1mol/L,答:所用盐酸的物质的量浓度是1.1mol/L;
(2)根据反应式:Al(OH)3+NaOH=NaAlO2+2H2O,当消耗0.2mol氢氧化钠时,氢氧化铝全部溶解,所以氢氧化铝的物质的量是0.2mol,根据铝元素守恒,所以氧化铝的物质的量是0.1mol,质量m(Al2O3)=0.1mol×102g/mol=10.2g,答:混合物中Al2O3的质量为10.2g;
(3)根据混合物的总质量是42.2g,氧化铝质量是10.2g,所以氧化铁和二氧化硅的总质量是32g,即氧化铁的质量位于0-32g之间,物质的量是0-0.2mol之间,0.1mol的氧化铝消耗0.6mol的氢氧化钠,所以氧化铝和氧化铁消耗盐酸的物质的量范围是0.6mol-1.8mol,对应反应后剩余氢氧化钠的物质的量是0.4mol-1.6mol,中和这些氢氧化钠消耗盐酸的物质的量是0.4mol-1.6mol,即a的取值范围为是0.4<a<1.6,故答案为:0.4<a<1.6.
| 2.2mol |
| 2L |
(2)根据反应式:Al(OH)3+NaOH=NaAlO2+2H2O,当消耗0.2mol氢氧化钠时,氢氧化铝全部溶解,所以氢氧化铝的物质的量是0.2mol,根据铝元素守恒,所以氧化铝的物质的量是0.1mol,质量m(Al2O3)=0.1mol×102g/mol=10.2g,答:混合物中Al2O3的质量为10.2g;
(3)根据混合物的总质量是42.2g,氧化铝质量是10.2g,所以氧化铁和二氧化硅的总质量是32g,即氧化铁的质量位于0-32g之间,物质的量是0-0.2mol之间,0.1mol的氧化铝消耗0.6mol的氢氧化钠,所以氧化铝和氧化铁消耗盐酸的物质的量范围是0.6mol-1.8mol,对应反应后剩余氢氧化钠的物质的量是0.4mol-1.6mol,中和这些氢氧化钠消耗盐酸的物质的量是0.4mol-1.6mol,即a的取值范围为是0.4<a<1.6,故答案为:0.4<a<1.6.
点评:本题考查化学计算,涉及方程式的计算、混合物的计算、图象计算等,难度中等,清楚图象各段反应是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.
(2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究. 某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.
某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.