题目内容
(10分) 请按要求填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的核组成符号: ;
(2)CO2的电子式是 ,NH4Cl的电子式是 ;
(3)物质在下列变化过程中克服的是:①共价键②离子键。(填序号)
HCl溶于水 ;电解熔融NaCl制Na ;电解水分解生成O2和H2 。
(4)下列物质中:
互为同分异构体的有 ;互为同素异形体的有 ;
属于同位素的有 ; 属于同一种物质的有 。(填序号)
①液氯 ②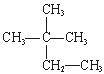 ③白磷 ④氯气 ⑤
③白磷 ④氯气 ⑤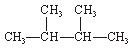
⑥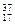 Cl ⑦
Cl ⑦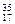 Cl ⑧红磷
Cl ⑧红磷
(1)写出表示含有8个质子、10个中子的原子的核组成符号: ;
(2)CO2的电子式是 ,NH4Cl的电子式是 ;
(3)物质在下列变化过程中克服的是:①共价键②离子键。(填序号)
HCl溶于水 ;电解熔融NaCl制Na ;电解水分解生成O2和H2 。
(4)下列物质中:
互为同分异构体的有 ;互为同素异形体的有 ;
属于同位素的有 ; 属于同一种物质的有 。(填序号)
①液氯 ②
 ③白磷 ④氯气 ⑤
③白磷 ④氯气 ⑤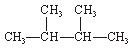
⑥
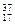 Cl ⑦
Cl ⑦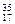 Cl ⑧红磷
Cl ⑧红磷(1)18 8O;(2)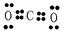
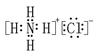 (3)①;②;①。
(3)①;②;①。
(4)②与⑤;③与⑧;; ⑥与⑦ ;①与④(每空1分)
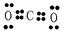
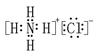 (3)①;②;①。
(3)①;②;①。(4)②与⑤;③与⑧;; ⑥与⑦ ;①与④(每空1分)
略

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目


 量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题: =1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。
=1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。 对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。 :在洁净铁(可用于合成氨
:在洁净铁(可用于合成氨

 SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。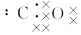 ,下列叙述,正确的是( )
,下列叙述,正确的是( )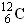 ,二氧化碳分子的结构式为O=C=O
,二氧化碳分子的结构式为O=C=O