题目内容
13.下列叙述中正确的是( )| A. | 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 | |
| B. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2. | |
| C. | 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 | |
| D. | 向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
分析 A、向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解生成碳酸氢钙,再向溶液中加入NaHCO3饱和溶液,与碳酸氢钙不反应;
B、根据碳酸钠、碳酸氢钠和盐酸反应的化学方程式来计算回答;
C、Na2CO3和NaHCO3分别与过量盐酸反应,根据含碳量大的放出CO2多判断;
D、Na2CO3较NaHCO3易溶.
解答 解:A、向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解生成碳酸氢钙,再向溶液中加入NaHCO3饱和溶液,与碳酸氢钙不反应,所以没有CaCO3沉淀生成,故A错误;
B、根据化学方程式:Na2CO3+HCl=NaCl+NaHCO3,当碳酸钠和盐酸物质的量相等时,不会产生二氧化碳,故B错误;
C、NaHCO3和Na2CO3都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,NaHCO3和Na2CO3质量相等时,物质的量不相等,所以同温同压下,生成的CO2体积不一样,故C错误;
D、向Na2CO3饱和溶液中通入CO2,会发生反应:Na2CO3+CO2+H2O=2NaHCO3,常温下相同的溶剂时,Na2CO3较NaHCO3易溶,所以析出的是碳酸氢钠,故D正确.
故选D.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
1.一定温度下,将a mol PCl5气体通入容积不变的反应器中,达到平衡:PCl5(g)?PCl3(g)+Cl2(g),测得平衡混合气体压强为P1,此时再向反应器中通入a mol PCl5气体,在温度不变再达平衡,测得平衡混合气体压强为P2,则( )
| A. | 2P1=P2 | B. | 2P1>P2 | C. | 2P1<P2 | D. | 无法确定 |
8.下列说法正确的是( )
| A. | 乙烯和聚氯乙烯都能发生加成反应 | |
| B. | 苯、乙醇和乙酸都可以发生取代反应 | |
| C. | 乙烷、乙醇和乙酸都可以与钠反应生成氢气 | |
| D. | 纤维素和蛋白质水解产物均是葡萄糖 |
2.用NA表示阿伏伽德罗常数的值,下列各物质所含的原子数是2NA的是( )
| A. | 16g H2 | B. | 16g S | C. | 24g Mg | D. | 24g C |
18.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
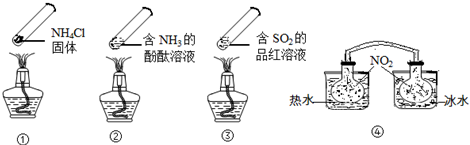

| A. | ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 | |
| B. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| C. | 加热时,②、③溶液均变红,冷却后又都变为无色 | |
| D. | 四个“封管实验”中所发生的化学反应都是可逆反应 |
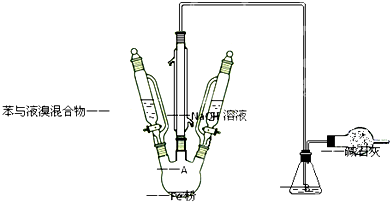
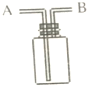 今有下列气体:H2、Cl2、O2、HCl、NH3、NO(难溶于水).用如图所示装置进行实验,请写下列空白:
今有下列气体:H2、Cl2、O2、HCl、NH3、NO(难溶于水).用如图所示装置进行实验,请写下列空白: