题目内容
(10分)
用KMnO4氧化密度为1.19g/cm3,溶质的质量分数为36.5%的盐酸。反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出上述反应中电子得失数目、化合价变化,并指出氧化剂和还原剂。
(2)求所用盐酸的物质的量浓度。
(3)15.8gKMnO4能使多少克HCl发生上述反应?产生的Cl2在标准状况下的体积为多少?
(共10分)
(1)
氧化剂:KMnO4 还原剂:HCl
(2)解: 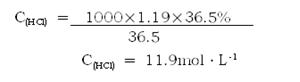
(3)设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2。
2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O
2×158 g 16×36.5 g 5×22.4 L
15.8 g x g y L 
解析试题分析 :
氧化剂:KMnO4 (化合价降低 ) 还原剂:HCl (化合价升高)
由c=1000ρw/M得: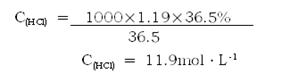
设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2。
2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O
2×158 g 16×36.5 g 5×22.4 L
15.8 g x g y L 
考点:氧化还原反应 双线桥
点评: 一、氧化还原反应的特点:氧化剂得电子,化合价降低,具有较强氧化性;还原剂失电子,化合价升高,具有较强还原性;
二、双线桥的表示基本步骤:
1.标变价
明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
2.连双线
将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
3.标得失
①标电子转移或偏离数
明确标出得失电子数,格式为“得/失 发生氧化还原反应原子个数×单位原子得失电子数”
②标化合价变化
一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
③标出元素反应类型
一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒
检查得失电子数是否相等,如不相等则重新分析。
