题目内容
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理。下列叙述正确的是(???? )
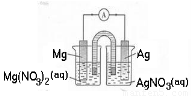
A.银片为负极,发生的反应为:Ag++e-= Ag
B.进行实验时,琼脂中K+移向Mg(NO3)2溶液
C.用稀硫酸代替AgNO3溶液,可形成原电池
D.取出盐桥,电流表依然有偏转
C
【解析】
试题分析:从图来看,该装置为Mg-Ag的原电池,由于金属镁比较活泼,所以在该原电池中镁做负极,失电子形成镁离子,A错误;银电极一侧得到电子,析出银单质,所以盐桥中的阳离子往右侧硝酸银溶液迁移,B错误;若把硝酸银换成稀硫酸,H+同样在银电极处得到电子析出氢气,所以可以构成原电池;所以C正确;取出盐桥,由于装置无法构成闭合回路,所以不能形成原电池,电路中无电子转移不产生电流,所以电流表不发生偏转,D错误;故选C。
考点:本题考查的是基础的原电池原理。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案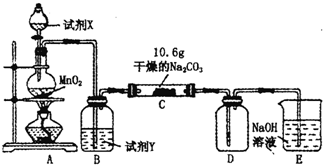 某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反得到固体物质的成分.
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反得到固体物质的成分.(1)A中制取Cl2的离子方程式
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究.
①提出合理假设.
假设1:存在两种成分:NaHCO3和
假设2:存在三种成分:NaHCO3和
②设计方案,进行实验.写出实验步骤以及预期现象和结论.
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
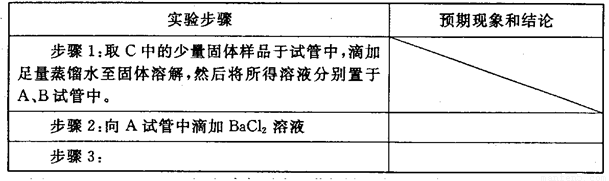
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
|
| 步骤2:向A试管中滴加适量BaCl2溶液. | |
| 步骤3: |
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
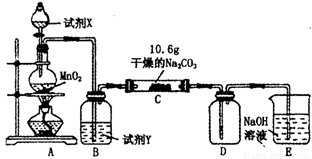
(1)A中制取Cl2的离子方
程式__________________
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. |
|
|
步骤2: 向A试管中滴加BaCl2溶液 |
|
|
步骤3: |
|
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为____________________________。
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
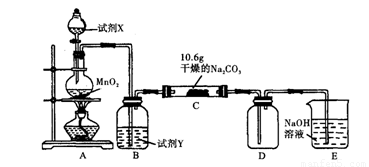
(1)试剂X的化学式 。A中制取Cl2的离子方程式 。
(2)试剂Y的名称为 。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
实验步骤 |
预期现象和结论 |
|
|
|
|
步骤2:向A试管中滴加BaCl2溶液 |
|
|
步骤3:
|
|
(4)已知,Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为:
。
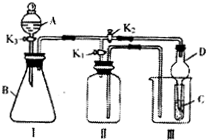 某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质.
某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质.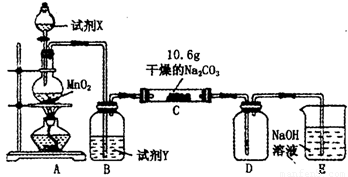
 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。