题目内容
(12分)(1)现有73g某双原子分子气体,它的摩尔质量为36.5 g·mol—1。则:
① 该气体的物质的量为 mol。
② 该气体所含原子数为 NA。
③ 该气体在标况下的体积为 L。
④ 该气体完全溶于500mL水后稀释到2L,物质的量浓度为 mol·L—1。
(2)将100mL 0.5mol/L Na2SO4溶液加水稀释到500mL,稀释后:c(Na+)= mol·L—1。
(3) g H2O中的O原子数目与标准状况下2.24LCO2中的O原子数目相同。
【答案】
(1)①2 ②4 ③44.8 ④ 1 (2)0.2 (3)3.6
【解析】考查有关物质的量的计算。
(1)①根据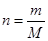 可知,m=73g÷36.5g/mol=2.0mol。
可知,m=73g÷36.5g/mol=2.0mol。
②因为是双原子分子气体,所以含有的原子是4mol。根据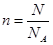 可知,原子数目是4NA。
可知,原子数目是4NA。
③根据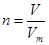 可知,气体在标况下的体积V=2.0mol×22.4L/mol=44.8L。
可知,气体在标况下的体积V=2.0mol×22.4L/mol=44.8L。
④根据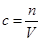 可知,稀释后的浓度是2.0mol÷2L=1.0mol/L。
可知,稀释后的浓度是2.0mol÷2L=1.0mol/L。
(2)由于稀释过程中溶质的浓度是不变的,所以稀释后溶液的浓度是0.5mol/L÷5=0.1mol/L.根据硫酸钠的化学式Na2SO4可知,稀释后c(Na+)=0.1mol/L×2=0.2mol/L。
(3)标准状况下2.24LCO2的物质的量是0.1mol,所以氧原子的物质的量是0.2mol,因此水的物质的量是0.2mol,其质量是m=n·M=0.2mol×18g/mol=3.6g。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目