题目内容
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。请你协助他们探究所得气体的成分。
Ⅰ【提出猜想】
猜想1:所得气体中可能是SO2。 猜想2:所得气体中可能是__________。
猜想3:所得气体中可能是_______的混合气体。
Ⅱ【实验探究】
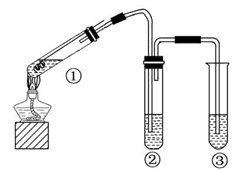
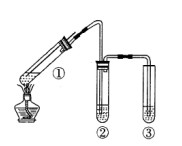
(1)将所得气体通入如下装置
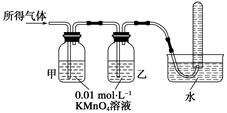
证明猜想3正确的实验现象是___________、______________、________________。
(2)点燃余下的气体前,必须要进行的操作是_________________________________。
(3)写出浓硫酸表现出强氧化性的化学反应方程式_____________________________。
(4)如果把一定量的铁与浓硫酸加热时产生的气体通过装有过量Na2O2粉末的玻璃管,则玻璃管中反应的生成物可能含有(填化学式)__________________ ___________ _。
Ⅰ【提出猜想】
猜想1:所得气体中可能是SO2。 猜想2:所得气体中可能是__________。
猜想3:所得气体中可能是_______的混合气体。
Ⅱ【实验探究】
(1)将所得气体通入如下装置

证明猜想3正确的实验现象是___________、______________、________________。
(2)点燃余下的气体前,必须要进行的操作是_________________________________。
(3)写出浓硫酸表现出强氧化性的化学反应方程式_____________________________。
(4)如果把一定量的铁与浓硫酸加热时产生的气体通过装有过量Na2O2粉末的玻璃管,则玻璃管中反应的生成物可能含有(填化学式)__________________ ___________ _。
Ⅰ猜想2:H2 猜想3:SO2和H2
Ⅱ(1)甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变(或变浅但不完全褪色);试管中收集到无色气体
(2)验纯
(3)2Fe+6H2SO4 Fe2(SO4)3+3SO2↑+6H2O (4)Na2SO4、Na2SO3、NaOH、O2
Fe2(SO4)3+3SO2↑+6H2O (4)Na2SO4、Na2SO3、NaOH、O2
Ⅱ(1)甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变(或变浅但不完全褪色);试管中收集到无色气体
(2)验纯
(3)2Fe+6H2SO4
 Fe2(SO4)3+3SO2↑+6H2O (4)Na2SO4、Na2SO3、NaOH、O2
Fe2(SO4)3+3SO2↑+6H2O (4)Na2SO4、Na2SO3、NaOH、O2试题分析:Ⅰ:铁是比较活泼的金属。比较活泼的金属与酸反应置换出氢气。所以猜想2的气体可能是H2。浓硫酸是氧化性的酸,反应开始时首先是浓硫酸与铁发生氧化还原反应2Fe+6H2SO4(浓)
 Fe2(SO4)3+3SO2↑+6H2O。随着反应的进行,硫酸变为稀硫酸这时发生反应:Fe+H2SO4(稀)=FeSO4+H2↑。所以猜想3:所得气体中可能是SO2和H2的混合物。Ⅱ:二氧化硫可以与酸性高锰酸钾发生反应使之褪色。利用这一点可以检验二氧化硫的存在。将混合气体先通过酸性高锰酸钾溶液来验证然后再通过酸性高锰酸钾溶液来除去二氧化硫气体。最后用排水法收集氢气。由于氢气是可燃性气体。所以在点燃前首先要验证纯度。否则发生危险。一定量的铁与浓硫酸加热时产生的气体中含有H2、 SO2及水蒸气。当通过装有过量Na2O2粉末的玻璃管,可能发生反应:SO2+Na2O2=Na2SO4;2Na2O2+2H2O=4NaOH+O2↑SO2+2NaOH=Na2SO3+H2O。故玻璃管中反应的生成物可能含有Na2SO4、Na2SO3、NaOH、O2。
Fe2(SO4)3+3SO2↑+6H2O。随着反应的进行,硫酸变为稀硫酸这时发生反应:Fe+H2SO4(稀)=FeSO4+H2↑。所以猜想3:所得气体中可能是SO2和H2的混合物。Ⅱ:二氧化硫可以与酸性高锰酸钾发生反应使之褪色。利用这一点可以检验二氧化硫的存在。将混合气体先通过酸性高锰酸钾溶液来验证然后再通过酸性高锰酸钾溶液来除去二氧化硫气体。最后用排水法收集氢气。由于氢气是可燃性气体。所以在点燃前首先要验证纯度。否则发生危险。一定量的铁与浓硫酸加热时产生的气体中含有H2、 SO2及水蒸气。当通过装有过量Na2O2粉末的玻璃管,可能发生反应:SO2+Na2O2=Na2SO4;2Na2O2+2H2O=4NaOH+O2↑SO2+2NaOH=Na2SO3+H2O。故玻璃管中反应的生成物可能含有Na2SO4、Na2SO3、NaOH、O2。
练习册系列答案
相关题目