题目内容
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )

A. 该反应的焓变△H<0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() >3
>3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
【答案】C
【解析】
A、由图可知,温度越高,φ(CH4)的体积分数越小,则升高温度,平衡正向移动;
B、起始![]() =Z,Z越大,即H2O促进CH4转化的程度越大,φ(CH4)的体积分数越小;
=Z,Z越大,即H2O促进CH4转化的程度越大,φ(CH4)的体积分数越小;
C、起始![]() =Z,转化时CH4(g)、H2O(g)以等物质的量转化;
=Z,转化时CH4(g)、H2O(g)以等物质的量转化;
D、该反应为气体体积增大的反应,增大压强,平衡逆向移动
A、由图可知,温度越高,φ(CH4)的体积分数越小,则升高温度,平衡正向移动,则正反应为吸热反应,该反应的焓变△H>0,故A错误;
B、起始![]() =Z,Z越大,即H2O促进CH4转化的程度越大,φ(CH4)的体积分数越小,则图中Z的大小为b>3>a,故B错误;
=Z,Z越大,即H2O促进CH4转化的程度越大,φ(CH4)的体积分数越小,则图中Z的大小为b>3>a,故B错误;
C、起始![]() =Z,转化时CH4(g)、H2O(g)以等物质的量转化,则X点对应的平衡混合物中
=Z,转化时CH4(g)、H2O(g)以等物质的量转化,则X点对应的平衡混合物中![]() >3,故C正确;
>3,故C正确;
D、该反应为气体体积增大的反应,增大压强,平衡逆向移动,则温度不变时,图中X点对应的平衡在加压后φ(CH4)增大,故D错误;故选C。

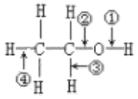
【题目】表格中如图是乙醇分子的化学键断键位置的示意图。下列对乙醇发生反应时的反应条件、断键方式及主要有机产物的叙述中错误的是( )
选项 | 反应条件 | 断键位置 | 主要有机产物 | 乙醇的分子结构 |
A.与钠反应 | 常温 | ① | CH3CH2ONa |
|
B.催化氧化 | Cu或Ag | ②③ | CH3COOH | |
C.消除反应 | 浓硫酸,170℃ | ③④ | CH2=CH2 | |
D.与HBr反应 | △ | ② | CH3CH2ONa |
A.AB.BC.CD.D