题目内容
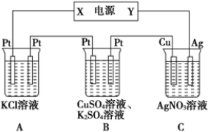 在如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
在如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:(1)pH变化:A
增大
增大
,B减小
减小
,C不变
不变
.(填“增大”“减小”或“不变”)
(2)请写出C池中发生反应的离子方程式
阳极为Ag-e-═Ag+,阴极为Ag++e-═Ag
阳极为Ag-e-═Ag+,阴极为Ag++e-═Ag
.(3)通电5min时,B中共收集224mL气体(标准状况),溶液体积为100mL.则通电前CuSO4溶液的物质的量浓度为
0.05 mol/L
0.05 mol/L
mol?L-1(设电解前后溶液体积无化).(4)若A中KCl溶液的体积是200mL,电解后,溶液的pH为
13
13
(设电解前后溶液体积无变化).分析:铜电极质量增加,说明铜电极为阴极,则银电极为阳极,则X为负极,Y为正极,电解时:A阳极为2Cl--2e-═Cl2↑,阴极为2H++2e-═H2↑,B中阳极为4OH--4e-═O2↑+2H2O,阴极为Cu2++2e-═Cu,C为电镀,以此解答该题.
解答:解:(1)A阳极为2Cl--2e-═Cl2↑,阴极为2H++2e-═H2↑,生成OH-,溶液pH增大,B中阳极为4OH--4e-═O2↑+2H2O,阴极为Cu2++2e-═Cu,生成H++,pH减小,C为电镀,溶液离子浓度不变,则pH不变,
故答案为:增大;减小;不变;
(2)C池中阳极为Ag-e-═Ag+,阴极为Ag++e-═Ag,
故答案为:阳极为Ag-e-═Ag+,阴极为Ag++e-═Ag;
(3)若通入直流电5min时,铜电极质量增加2.16g,则发生Ag++e-═Ag,n(Ag)=
=0.02mol,转移电子0.02mol,
B中阳极反应为4OH--4e-═O2↑+2H2O,生成n(O2)=0.02mol×
=0.005mol,体积为0.005mol×22.4L/mol=0.12mL,即112mL,
通电5min时,B中共收集224mL气体(标准状况),则阴极还应生成112mLH2,得到电子0.01mol,
所以析出铜得到0.01mol电子,
由Cu2++2e-═Cu可知,n(Cu2+)=0.005mol,则
通电前CuSO4溶液的物质的量浓度为
=0.05mol/L,
故答案为:0.05 mol/L;
(4)若A中KCl溶液的体积是200mL,通入直流电5min时,由(3)计算可知转移电子0.02mol,
阴极为2H++2e-═H2↑,则生成n(OH-)=0.02mol,
电解后,溶液的c(OH-)=
=0.1mol/L,
pH=13,
故答案为:13.
故答案为:增大;减小;不变;
(2)C池中阳极为Ag-e-═Ag+,阴极为Ag++e-═Ag,
故答案为:阳极为Ag-e-═Ag+,阴极为Ag++e-═Ag;
(3)若通入直流电5min时,铜电极质量增加2.16g,则发生Ag++e-═Ag,n(Ag)=
| 2.16g |
| 108g/mol |
B中阳极反应为4OH--4e-═O2↑+2H2O,生成n(O2)=0.02mol×
| 1 |
| 4 |
通电5min时,B中共收集224mL气体(标准状况),则阴极还应生成112mLH2,得到电子0.01mol,
所以析出铜得到0.01mol电子,
由Cu2++2e-═Cu可知,n(Cu2+)=0.005mol,则
通电前CuSO4溶液的物质的量浓度为
| 0.005mol |
| 0.1L |
故答案为:0.05 mol/L;
(4)若A中KCl溶液的体积是200mL,通入直流电5min时,由(3)计算可知转移电子0.02mol,
阴极为2H++2e-═H2↑,则生成n(OH-)=0.02mol,
电解后,溶液的c(OH-)=
| 0.02mol |
| 0.2L |
pH=13,
故答案为:13.
点评:本题考查电解原理,侧重于学生的分析能力和计算能力的考查,为高考高频考点,难度中等,注意把握离子的放电顺序,为解答该题的关键.

练习册系列答案
相关题目
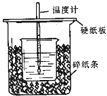 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: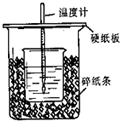 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: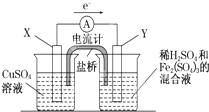 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化).
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化). 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2白色沉淀.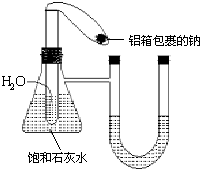 在如图所示的装置中,锥形瓶中装有饱和石灰水,小试管中装有一定量的水,气球中有一小块用铝箔包着的钠,整套装置气密性良好,未反应前U形管两端液面相平.现将气球中的金属钠放入小试管中与水反应.
在如图所示的装置中,锥形瓶中装有饱和石灰水,小试管中装有一定量的水,气球中有一小块用铝箔包着的钠,整套装置气密性良好,未反应前U形管两端液面相平.现将气球中的金属钠放入小试管中与水反应.