题目内容
恒温恒容下,将2 mol A气体和2 mol B气体通入体积为(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________。
(2)x=____________。
(3)A的转化率与B的转化率之比为____________。
(4)下列各项可作为该反应达到平衡状态的标志的是____________(填各项代号)
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.A的消耗速率与B的消耗速率之比为2∶1
(5)若向平衡混合物的容器中再充入2 mol A气体和2 mol B气体,在原温度下达到新的平衡,此时B的物质的量n(B)为____________。
(6)欲使反应达到平衡时C的物质的量分数与上述平衡相等,起始加入的A、B物质的量n(A)、n(B)之间应满足的关系为________________________。
(1)0.6 mol/(L·min) (2)3 (3)2∶1 (4)BC (5)2.4 mol (6)n(A)=n(B)或n(A)∶n(B)=1∶1
解析: ![]() xC+2D(s)
xC+2D(s)
起始(mol): 2 2 0 0
变化(mol): 1.6 0.8 2.4
平衡(mol):0.4 1.2 2.4
所以x=3。

铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中H2O的平衡转化率为_______ (结果保留一位小数)。
②下列说法正确的是_______ (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
起始/mol |
3.0 |
4.0 |
0 |
0 |
|
平衡/mol |
m |
n |
p |
q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
|
|
Fe |
H2O(g) |
Fe3O4 |
H2 |
|
A/mol |
3.0 |
4.0 |
0 |
0 |
|
B/mol |
0 |
0 |
1 |
4 |
|
C/mol |
m |
n |
p |
q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是
________(用A、B、C表示)。
(5)已知Fe(OH)3的Ksp=2.79×10-39,而FeCl3溶液总是显示较强的酸性,若某FeCl3溶液的pH为3,则该溶液中c(Fe3+)=________mol • L-1 (结果保留3位有效数字)

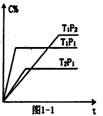
 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
 (注:x为P物质前的系数)①将3mol M和2
mol N在一定条件下反应,达平衡时P的体积分数为a;②若起始时M、N、P投入的物质的量分别为n(M)、n(N)、n(P),平衡时P的体积分数也为a。则下列说法正确的是 ( )
(注:x为P物质前的系数)①将3mol M和2
mol N在一定条件下反应,达平衡时P的体积分数为a;②若起始时M、N、P投入的物质的量分别为n(M)、n(N)、n(P),平衡时P的体积分数也为a。则下列说法正确的是 ( ) pC(g)。
pC(g)。