��Ŀ����
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⣮
(1)CO�����ںϳɼ״�����ѹǿΪ0.1 Mpa�����£������ΪbL���ܱ������г���a mol��CO��2a mol��H2���ڴ��������ºϳɼ״���
CO(g)��2H2(g)![]() CH3OH(g)ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��
CH3OH(g)ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��
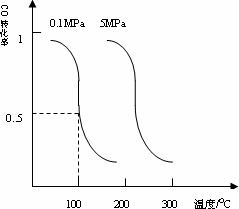
(��)�÷�Ӧ����________��Ӧ��(����ȡ����ȡ�)��
(��)100��ʱ���÷�Ӧ��ƽ�ⳣ����K��________��(��a��b�Ĵ���ʽ��ʾ)����һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴԴ˷�Ӧ��˵����ȷ���ǣ�________�����)
�÷�Ӧʹ�ô������岻��
�÷�Ӧ�������ںܶ�ʱ������ɣ�
�÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��ٷֺ�����С��
�÷�Ӧһ���Ƿ��ȷ�Ӧ��
(��)���¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol��CO��2a mol��H2���ﵽƽ��ʱCOת����________(����������䡱��С������ͬ)ƽ�ⳣ����________��
(��)��ij�¶��£���һ�ݻ�������ܱ������г���2.5 mol��CO��7.5 mol��H2����Ӧ����CH3OH(g)���ﵽƽ��ʱ��COת����Ϊ90������ʱ������ѹǿΪ��ʼʱ��ѹǿ________����
(2)ij�¶������£�����CO2(g)��H2(g)�������1��4��ϣ����ʵ�ѹǿ�ʹ��������¿��Ƶü��飬��֪��
CH4(g)��2O2(g)![]() CO2(g)��2H2O(l)����H����890.3 KJ/mol
CO2(g)��2H2O(l)����H����890.3 KJ/mol
H2(g)��1/2O2(g)��H2O(l)����H����285.8 KJ/mol
��CO2(g)��H2(g)��Ӧ����Һ̬ˮ���Ȼ�ѧ����ʽΪ��________��
������
|
�����𰸣�(1)(��)���� ����(��)b2/a2��C(��)�����䡡(��)0.55 ����(2)CO2(g)��4H2(g) ����������(1)(��)�۲�ͬһѹǿ�µ�COת�������¶ȵ����߶���С����������ӦӦΪ���ȷ�Ӧ�� ����(��)100��ʱCO��ת����Ϊ0.5����ʽ���㣺 ���� ����K����ƽ��ʱ������Ũ����֮�����Է�Ӧ��Ũ����֮�������KΪb2/a2�� ������Ӧ���Kֵ��ֻ��˵����Ӧ���еij̶ȴ���ȷ���䷴Ӧ���ʴ�С��Ҳ����ȷ����Ӧ�����Ȼ��Ƿ��ȣ� ����(��)���ڸ÷�ӦΪ���������С�ķ�Ӧ����ͨ��a mol��CO��2a mol��H2������ƽ��������Ӧ�����ƶ�������COת��������ƽ�ⳣ�����¶�ϵ������Ũ���أ����Բ���ı䣮 ����(��) ���� ��������ѹǿ֮�ȵ������ʵ���֮�ȣ�ƽ��ʱ�����ʵ�������Ϊ5.5 mol����ʼʱΪ10 mol������ƽ��ʱѹǿΪ��ʼʱ��0.55���� ����(2)���ݸ�˹���ɣ��ɷ�Ӧ�ڡ�4���ٿɵã� |

��11�֣��о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⡣
��1��CO�����ںϳɼ״�����ѹǿΪ0.1Mpa�����£������ΪbL���ܱ������г���amolCO��2amolH2���ڴ��������ºϳɼ״���
CO��g��+2H2��g�� CH3OH��g��ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��
CH3OH��g��ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ����ͼ��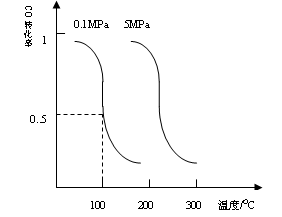
��i���÷�Ӧ����_____________��Ӧ��������ȡ����ȡ�����
��ii��100��ʱ���÷�Ӧ��ƽ�ⳣ����K=_____________������a��b�Ĵ���ʽ��ʾ����
��һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴԴ˷�Ӧ��˵����ȷ���ǣ�_________________����ţ�
| A���÷�Ӧʹ�ô������岻�� |
| B���÷�Ӧ�������ںܶ�ʱ������ɣ� |
| C���÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��ٷֺ�����С�� |
| D���÷�Ӧһ���Ƿ��ȷ�Ӧ�� |
��iv����ij�¶��£���һ�ݻ�������ܱ������г���2.5molCO��7.5molH2����Ӧ����CH3OH��g�����ﵽƽ��ʱ��COת����Ϊ90%����ʱ������ѹǿΪ��ʼʱ��ѹǿ__________����
��2��ij�¶������£�����CO2��g����H2��g���������1��4��ϣ����ʵ�ѹǿ�ʹ��������¿��Ƶü��飬��֪��
CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3KJ/mol
H2��g��+1/2O2��g��= H2O��l�� ��H=-285.8KJ/mol
��CO2��g����H2��g����Ӧ����Һ̬ˮ���Ȼ�ѧ����ʽΪ��_________________________��
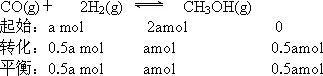
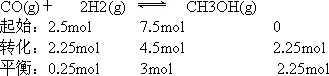
 ��2012?��������ģ���о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ���⣮CO�����ںϳɼ״�����ѹǿΪ0.1MPa�����£������Ϊb L���ܱ������г���a mol CO��2a mol H2���ڴ��������ºϳɼ״���CO��g��+2H2��g��?CH3OH��g����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
��2012?��������ģ���о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ���⣮CO�����ںϳɼ״�����ѹǿΪ0.1MPa�����£������Ϊb L���ܱ������г���a mol CO��2a mol H2���ڴ��������ºϳɼ״���CO��g��+2H2��g��?CH3OH��g����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ�� (1)100��ʱ���÷�Ӧ��ƽ�ⳣ��:
(1)100��ʱ���÷�Ӧ��ƽ�ⳣ��: