题目内容
有200mLMgCl2和AlCl3混合液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,欲将Mg2+、Al3+恰好转化为沉淀,需加4mol/LNaOH溶液
- A.65mL
- B.40mL
- C.72mL
- D.128mL
A
分析:利用MgCl2和AlCl3与NaOH反应方程式进行计算,然后利用离子守恒计算.
解答:发生反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,
将Mg2+、Al3+恰好转化为沉淀,观察反应方程式可知,此时,溶液恰好为NaCl溶液,所以,n(Na+)=n(Cl-),
Na+来源于4mol/LNaOH溶液,Cl-来源于200mLMgCl2和AlCl3混合液溶液,
由离子守恒知:n(Na+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,所以,需加4mol/LNaOH溶液体积为: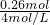 =0.065L=65ml,
=0.065L=65ml,
故选A.
点评:本题考查的是镁、铝的重要化合物结合离子方程式的计算,巧妙利用离子守恒化繁为简是解本题的好方法.
分析:利用MgCl2和AlCl3与NaOH反应方程式进行计算,然后利用离子守恒计算.
解答:发生反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,
将Mg2+、Al3+恰好转化为沉淀,观察反应方程式可知,此时,溶液恰好为NaCl溶液,所以,n(Na+)=n(Cl-),
Na+来源于4mol/LNaOH溶液,Cl-来源于200mLMgCl2和AlCl3混合液溶液,
由离子守恒知:n(Na+)=n(Cl-)=0.2L×1.3mol/L=0.26mol,所以,需加4mol/LNaOH溶液体积为:
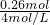 =0.065L=65ml,
=0.065L=65ml,故选A.
点评:本题考查的是镁、铝的重要化合物结合离子方程式的计算,巧妙利用离子守恒化繁为简是解本题的好方法.

练习册系列答案
相关题目