��Ŀ����
���û�ѧ��Ӧԭ���о��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
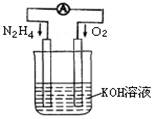
��1����������ʱ�����£�N2H4����ȼ�ϣ��䷽��ʽΪ��N2H4+O2=N2+2H2O�������˷�Ӧ��Ƴ���ͼ��ʾ��ԭ���װ�ã���ش�
�ٸ�����ӦʽΪ�� �� ��
�ڹ���һ��ʱ�������������Һ��pH�仯Ϊ �� ���������С�����䡱����
�����øõ�ص����ʯīΪ�缫��100mL�Ȼ�ͭ��Һ��һ��ʱ����������ռ���2.24L���壨�ѻ���ɱ�״���µ����������ԭ��Һ��Cu2+�����ʵ���Ũ��Ϊ �� ��
��2����25��ʱ����Ũ�Ⱦ�Ϊ0.1mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ���������� �� �������ѧʽ�������ɸó��������ӷ���ʽΪ �� ������֪25�� Ksp[Mg (OH)2]=1.8��10-11��Ksp[Cu (OH)2]=2.2��10-20����
��3����25��ʱ����a mol��L-1�İ�ˮ��0.01mol��L-1������������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)= c(Cl��)������Һ�� �� �ԣ���ᡱ������С���,�ú�a�Ĵ���ʽ��ʾNH3�� H2O�ĵ��볣��kb= �� ��
��1����������ʱ�����£�N2H4����ȼ�ϣ��䷽��ʽΪ��N2H4+O2=N2+2H2O�������˷�Ӧ��Ƴ���ͼ��ʾ��ԭ���װ�ã���ش�

�ٸ�����ӦʽΪ�� �� ��
�ڹ���һ��ʱ�������������Һ��pH�仯Ϊ �� ���������С�����䡱����
�����øõ�ص����ʯīΪ�缫��100mL�Ȼ�ͭ��Һ��һ��ʱ����������ռ���2.24L���壨�ѻ���ɱ�״���µ����������ԭ��Һ��Cu2+�����ʵ���Ũ��Ϊ �� ��
��2����25��ʱ����Ũ�Ⱦ�Ϊ0.1mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ���������� �� �������ѧʽ�������ɸó��������ӷ���ʽΪ �� ������֪25�� Ksp[Mg (OH)2]=1.8��10-11��Ksp[Cu (OH)2]=2.2��10-20����
��3����25��ʱ����a mol��L-1�İ�ˮ��0.01mol��L-1������������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)= c(Cl��)������Һ�� �� �ԣ���ᡱ������С���,�ú�a�Ĵ���ʽ��ʾNH3�� H2O�ĵ��볣��kb= �� ��
(11��)
��1����N2H4+4OH����4e��=N2+4H2O (2��) ������(1��)
�� 0.5 mol��L-1��(2��)����λ��д�����֣�
��2��Cu(OH)2 (1��) Cu2++2NH3��H20= Cu(OH)2 ��+2NH4+ (2��)
��3���� (1��) ,
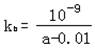 (2��)
(2��)��

��ϰ��ϵ�д�
 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����Ŀ
 �����й�KI3�������У�������ǡ�
�����й�KI3�������У�������ǡ�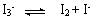 ��
��