题目内容
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图1所示:
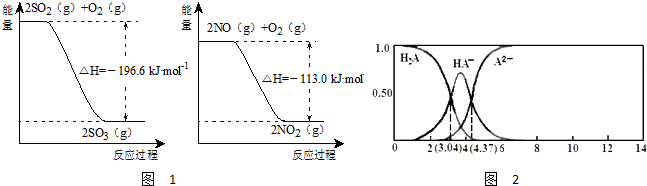
则NO2氧化SO2的热化学方程式为 .
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g)═N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
则平衡时氨气的转化率为 .
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如图2所示:
已知:103.04=1.1×103,104.37=2.3×104;25℃,Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11
①若向0.1mol?L-1 NaHA溶液中加入少量NaOH溶液,
的值 (填“增大”、“减小”或“不变”,下同),
的值 .
②若向0.1NaHAmol?L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+) c(A)(填“大于”、“小于”或“等于”).
③计算HA二级电离平衡常数Ka2= .
④将过量H2A加入Na2CO3溶液中反应的离子方程式为: .

则NO2氧化SO2的热化学方程式为
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g)═N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P: 100kPa |
5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如图2所示:
已知:103.04=1.1×103,104.37=2.3×104;25℃,Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11
①若向0.1mol?L-1 NaHA溶液中加入少量NaOH溶液,
| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
②若向0.1NaHAmol?L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+)
③计算HA二级电离平衡常数Ka2=
④将过量H2A加入Na2CO3溶液中反应的离子方程式为:
考点:化学平衡的计算,弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算,氮的氧化物的性质及其对环境的影响
专题:基本概念与基本理论
分析:(1)根据图示写出两个热化学方程式,根据盖斯定律由这两个反应得到NO2(g)与SO2(g)生成SO3(g)和NO(g)的反应热,再书写热化学反应方程式;
(2)根据数据判断4分钟达到平衡,利用压强之比等于物质的量之比计算;
(3)①在溶液中存在HA- H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
的值增大,
变小,据此答题;
②向0.1NaHAmol?L-1溶液中加入氨水至溶液呈中性,根据质子守恒可得c(H2A)+c(NH4+)=c(OH-)+c(A2-),因为溶液呈中性,即c(H+)=c(OH-),所以c(H2A)+c(NH4+)=c(A2-),据此答题;
③根据HA- H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
=c(H+)=10-4.37=4.35×10-5,据此答题;
④因为Ka1(H2CO3)=4.4×10-7,小于H2A的二级电离平衡常数4.35×10-5,所以HA-的酸性强于H2CO3,根据强酸制弱酸的道理,可写出方程式:2H2A+CO32-=2HA-+CO2↑+H2O,据此答题.
(2)根据数据判断4分钟达到平衡,利用压强之比等于物质的量之比计算;
(3)①在溶液中存在HA-
 H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
②向0.1NaHAmol?L-1溶液中加入氨水至溶液呈中性,根据质子守恒可得c(H2A)+c(NH4+)=c(OH-)+c(A2-),因为溶液呈中性,即c(H+)=c(OH-),所以c(H2A)+c(NH4+)=c(A2-),据此答题;
③根据HA-
 H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=| c(A2-)?c(H+) |
| c(HA-) |
④因为Ka1(H2CO3)=4.4×10-7,小于H2A的二级电离平衡常数4.35×10-5,所以HA-的酸性强于H2CO3,根据强酸制弱酸的道理,可写出方程式:2H2A+CO32-=2HA-+CO2↑+H2O,据此答题.
解答:
解:(1)由图示得到以下两个方程式:
①2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1,
②2NO(g)+O2(g) 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,
根据盖斯定律可知,由
可得NO2(g)+SO2(g)═SO3(g)+NO(g),
则△H=
=-41.8kJ?mol-1,
故答案为:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1;
(2)根据数据判断4分钟达到平衡,设氨气的转化率为a,利用压强之比等于物质的量之比计算;
2NH3 ?N2+3H2 △n
2 1 3 2
a 0.5a 1.5a a
=
,解得a=0.4,故氨气的转化率为40%,故答案为:40%;
(3)①在溶液中存在HA- H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
的值增大,
变小,故答案为:增大;减小;
②向0.1NaHAmol?L-1溶液中加入氨水至溶液呈中性,根据质子守恒可得c(H2A)+c(NH4+)=c(OH-)+c(A2-),因为溶液呈中性,即c(H+)=c(OH-),所以c(H2A)+c(NH4+)=c(A2-),故答案为:等于;
③根据HA- H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
=c(H+)=10-4.37=4.35×10-5,故答案为:4.35×10-5;
④因为Ka1(H2CO3)=4.4×10-7,小于H2A的二级电离平衡常数4.35×10-5,所以HA-的酸性强于H2CO3,根据强酸制弱酸的道理,可写出方程式:2H2A+CO32-=2HA-+CO2↑+H2O,故答案为:2H2A+CO32-=2HA-+CO2↑+H2O.
①2SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1,②2NO(g)+O2(g)
 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,根据盖斯定律可知,由
| ①-② |
| 2 |
则△H=
| -196.6kJ/mol-(-113.0kJ/mol) |
| 2 |
故答案为:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1;
(2)根据数据判断4分钟达到平衡,设氨气的转化率为a,利用压强之比等于物质的量之比计算;
2NH3 ?N2+3H2 △n
2 1 3 2
a 0.5a 1.5a a
| 5 |
| 7 |
| 1 |
| 1+a |
(3)①在溶液中存在HA-
 H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
②向0.1NaHAmol?L-1溶液中加入氨水至溶液呈中性,根据质子守恒可得c(H2A)+c(NH4+)=c(OH-)+c(A2-),因为溶液呈中性,即c(H+)=c(OH-),所以c(H2A)+c(NH4+)=c(A2-),故答案为:等于;
③根据HA-
 H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=| c(A2-)?c(H+) |
| c(HA-) |
④因为Ka1(H2CO3)=4.4×10-7,小于H2A的二级电离平衡常数4.35×10-5,所以HA-的酸性强于H2CO3,根据强酸制弱酸的道理,可写出方程式:2H2A+CO32-=2HA-+CO2↑+H2O,故答案为:2H2A+CO32-=2HA-+CO2↑+H2O.
点评:本题主要考查了化学原理中的热化学方程式的书写、溶液中电解质电离平衡的影响因素、电离平衡常数的应用等知识点,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A、室温下,10L,pH=13的NaOH溶液中含有Na+的数目为NA |
| B、常温常压下,17g氨气中含有氢原子的数目为NA |
| C、1mol/L的Na2SO3溶液1L加热蒸干得到固体产物转移的电子数目为4NA |
| D、体积为1L、物质的量浓度为1mol?L-1的Na2CO3溶液中含有NA个CO32- |
一定条件下,将1mol A和3mol B充入恒容容器中,发生如下反应:A(g)+3B(g)?2C(s),下列说法能说明该反应已经达到平衡状态的是( )
| A、气体的密度不再增大 |
| B、混合气体中A的体积分数不再变化 |
| C、混合气体的总压不再变化 |
| D、单位时间内生成a mol A,同时生成3a mol B |
 如图,A是一种非金属单质,E是一种白色沉淀.据图填空:
如图,A是一种非金属单质,E是一种白色沉淀.据图填空: (1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式