题目内容
【题目】乙二醛(OHC﹣CHO)是一种重要的精细化工产品.
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为;
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC﹣CHO(g)+2H2(g)HOCH2CH2OH(g)△H=﹣78kJmol﹣1 K1
2H2(g)+O2(g)2H2O(g)△H=﹣484kJmol﹣1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)OHC﹣CHO(g)+2H2O(g)的△H=kJmol﹣1;相同温度下,该反应的化学平衡常数K=(用含K1、K2的代数式表示);
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图1所示.反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是、;
(3)Ⅱ.乙二醛电解氧化制备乙醛酸(OHC﹣COOH)的生产装置如图2所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
①阴极反应式为;
②阳极液中盐酸的作用,除了产生氯气外,还有;
③保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=;
(设:法拉第常数为f Cmol﹣1;η= ![]() ×100% )
×100% )
【答案】
(1)3CH3CHO+4HNO3 ![]() 3OHC﹣CHO+4NO↑+5H2O
3OHC﹣CHO+4NO↑+5H2O
(2)﹣406;![]() ;升高温度,主反应平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物
;升高温度,主反应平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物
(3)2H++2e﹣=H2↑;增强溶液导电性;![]() %
%
【解析】解:(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO,反应方程式为:3CH3CHO+4HNO3 ![]() 3OHC﹣CHO+4NO↑+5H2O,
3OHC﹣CHO+4NO↑+5H2O,
所以答案是:3CH3CHO+4HNO3 ![]() 3OHC﹣CHO+4NO↑+5H2O;
3OHC﹣CHO+4NO↑+5H2O;
(2.)①已知:Ⅰ.OHC﹣CHO(g)+2H2(g)HOCH2CH2OH(g)△H=﹣78kJmol﹣1 K1
Ⅱ.2H2(g)+O2(g)2H2O(g)△H=﹣484kJmol﹣1 K2
根据盖斯定律,Ⅱ﹣Ⅰ可得:HOCH2CH2OH(g)+O2(g)OHC﹣CHO(g)+2H2O(g),则△H=﹣484kJmol﹣1﹣(﹣78kJmol﹣1)=﹣406kJmol﹣1 , 平衡常数K反应Ⅱ与Ⅰ的平衡常数的商,即K= ![]() ,
,
所以答案是:﹣406; ![]() ;
;
②主反应HOCH2CH2OH(g)+O2(g)OHC﹣CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低,
所以答案是:升高温度,主反应平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
(3.)①阴极是氢离子放电生成氢气,电极反应式为:2H++2e﹣=H2↑,
所以答案是:2H++2e﹣=H2↑;
②阳极液中盐酸可以增强溶液导电性,
所以答案是:增强溶液导电性;
③电极通过总电量为60t s×a A=60ta C,则电极上通过电子总物质的量= ![]() mol;生成乙醛酸的物质的量为
mol;生成乙醛酸的物质的量为 ![]() =
= ![]() mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2×
mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2× ![]() mol,故电解中的电流效率η=
mol,故电解中的电流效率η= 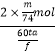 ×100%=
×100%= ![]() %,
%,
所以答案是: ![]() %.
%.
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热),还要掌握化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效))的相关知识才是答题的关键.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 .
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是;
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性,用化学平衡原理解释;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):;
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: 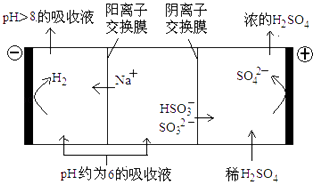
①HSO3﹣在阳极放电的电极反应式是;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理 .