题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g) =2NO2(g) ΔH = +133 kJ·mol-1
H2O(g) = H2O(l) ΔH =-44 kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:__________________________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均摩尔质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。________________________

(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______ K(II)(填“﹥”、“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH) =______________ 。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”)______g。
【答案】 4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=—1100.2kJ·mol-1 低温 d e 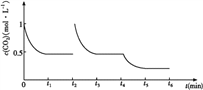 < < 0.025 mol·L-1 ·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
< < 0.025 mol·L-1 ·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
【解析】I、根据氢气的热值可书写氢气的热化学方程式为2H2(g)+ O2(g)=H2O(l) △H=-142.9×4kJ/mol=-571.6kJ/mol,根据盖斯定律,将已知热化学方程式中的氧气与液态水消去得到H2还原NO2生成水蒸气和氮气的热化学方程式,为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ·mol-1;
II、(1)①该反应的△S<0,所以若反应自发进行,则△H<0,因此根据△G=△H-T△S可知反应自发进行的条件是低温自发;②a、该体系中的气体只有二氧化碳和氢气,且二者的起始物质的量之比等于化学方程式中的化学计量数之比,所以混合气体的平均式量始终不变,不能判断为平衡状态,a错误;b、二氧化碳与氢气始终是1:3的关系,所以CO2和H2的体积分数保持不变的状态不是平衡状态,b错误;c、二氧化碳与氢气的起始物质的量之比等于化学方程式中的化学计量数之比,所以二者的转化率一定相等,与是否达到平衡状态无关,c错误;d 、因为该体系中有液体参加,所以气体的质量在逐渐减少,则气体的密度减小,达平衡时,保持不变,d正确;e、1mol CO2生成的同时有3mol H-H键断裂,符合正逆反应速率相等,是平衡状态,e正确。答案选de;③在t2时将容器容积缩小一倍,二氧化碳的浓度瞬间增大到1mol/L,则压强增大,平衡正向移动, t3时达到平衡,达到的平衡与原平衡相同,浓度仍是0.5mol/L;该反应是放热反应,t4时降低温度,则平衡正向移动,t5时达到平衡,则二氧化碳的浓度将小于0.5mol/L,对应的图像为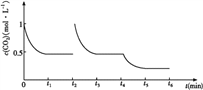 。
。
(2)①因为生成甲醇的反应是放热反应,而反应II是从逆反应开始的,所以反应吸热,绝热容器的温度要低于恒温容器,即反应I温度高于反应II,温度升高,放热反应的平衡常数减小,则K(I)<K(II);二者都是恒容条件,若是恒温恒容,二者达到的平衡是等效平衡,甲醇的浓度相同,而反应I温度高于反应II,所以反应II需再降低温度,而温度降低,平衡正向移动,则甲醇的浓度增大,平衡时CH3OH的浓度c(I)<c(II);②对反应I,前10min内氢气的物质的量减少6mol-4.5mol=1.5mol,则甲醇的物质的量增加0.5mol,所以前10min内平均反应速率v(CH3OH)=0.5mol/(2L×10min)=0.025mol ·L-1·min-1;30min时是平衡状态,生成甲醇1mol,则消耗氢气3mol,平衡时氢气的物质的量是3mol,而改变温度后氢气的物质的量变为3.2mol,物质的量增大,说明平衡逆向移动,因为该反应是放热反应,所以升高温度,平衡逆向移动,则T1<T2;若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),根据表中数据计算该温度下的平衡常数为K=1/6.75,此时Qc=1/6.75=K,所以平衡不移动。
(3)①离子交换膜为质子膜,则电解质溶液呈酸性,根据总的电池反应为2H2O + 2CO2=2HCOOH + O2可知,该反应中C元素化合价由+4价变为+2价,O元素化合价由-2价变为0价,所以1是负极、2是正极,(也可根据装置图中电子的流向判断1是负极、2是正极),负极上水失电子生成氢离子和氧气,判断电极1电极反应:2H2O-4e-=O2+4H+,酸性增强,H+通过质子膜进入到电极2区域;电极2通入二氧化碳,酸性条件下生成HCOOH,电极反应:CO2+2H++2e-=HCOOH;②从总反应看,每消耗1molCO2,就会消耗1molH2O,现有标准状况下,11.2L CO2即0.5mol反应,那就会消耗0.5molH2O即电极1室液体质量减少9g。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g) ===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g) ===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:__________________________。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①该反应的ΔS____(填“>”或“<”)0。右图中曲线a到曲线b的措施是_____________________________。

②已知CO中的C与O之间为三键,其键能为x kJ·mol-1,则x=____。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42 - |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。

(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2,O2穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______。