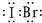题目内容
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)基态溴原子的电子排布式为
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为
(3)气态氟化氢中存在二聚分子(HF)2,这是由于
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的实际空间构型为
(5)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为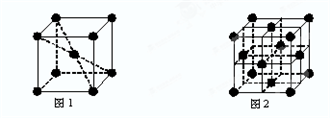
(1)基态溴原子的电子排布式为
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s24p5
.(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为
BrI>ICl>Cl2
BrI>ICl>Cl2
.(3)气态氟化氢中存在二聚分子(HF)2,这是由于
HF分子间形成氢键
HF分子间形成氢键
.(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的实际空间构型为
V形
V形
.(5)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是
MgO
MgO
.(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为
2:3
2:3
.
分析:(1)溴原子核外电子数为35,根据核外电子排布规律书写基态溴原子的电子排布式;
(2)Cl2、BrI、ICl结构相似,都是可以形成分子晶体,相对分子质量越大,沸点越高;
(3)F元素电负性获得,气态HF分子间形成氢键;
(4)中心I原子的价层电子对数为=
=4,价层电子对为正四面体,中心I原子的孤电子对数为
=2,据此判断;
(5)离子键越强,熔点越高,根据离子半径与离子所带电荷来分析;
(6)根据图1可知Fe原子的配位数为8,图2中Fe原子的配位数为12,据此计算判断.
(2)Cl2、BrI、ICl结构相似,都是可以形成分子晶体,相对分子质量越大,沸点越高;
(3)F元素电负性获得,气态HF分子间形成氢键;
(4)中心I原子的价层电子对数为=
| 7+1×2-1 |
| 2 |
| 7-1×2-1 |
| 2 |
(5)离子键越强,熔点越高,根据离子半径与离子所带电荷来分析;
(6)根据图1可知Fe原子的配位数为8,图2中Fe原子的配位数为12,据此计算判断.
解答:解:(1)溴的原子的质子数为35,核外电子数为35,由核外电子排布规律可知其电子排布式为1s22s22p63s23p63d104s24p5;
故答案为:1s22s22p63s23p63d104s24p5;
(2)因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,即沸点BrI>ICl>Cl2 .
故答案为:BrI>ICl>Cl2.
(3)因F的电负性最大,则HF分子中存在氢键形成二聚分子.
故答案为:HF分子间形成氢键;
(4)中心I原子的价层电子对数为=
=4,价层电子对为正四面体,中心I原子的孤电子对数为
=2,则I3+的空间构型为V形;
故答案为:V形;
(5)KCl晶体中钾离子、氯离子半径都大于镁离子、氧离子半径,镁离子、氧离子所带的电荷多,故MgO中离子键更强,故MgO的熔点更高;
故答案为:MgO;
(6)根据图1可知Fe原子的配位数为8,图2中Fe原子的配位数为12,故图1和图2的结构中铁原子的配位数之比为8:12=2:3;
故答案为:2:3.
故答案为:1s22s22p63s23p63d104s24p5;
(2)因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,即沸点BrI>ICl>Cl2 .
故答案为:BrI>ICl>Cl2.
(3)因F的电负性最大,则HF分子中存在氢键形成二聚分子.
故答案为:HF分子间形成氢键;
(4)中心I原子的价层电子对数为=
| 7+1×2-1 |
| 2 |
| 7-1×2-1 |
| 2 |
故答案为:V形;
(5)KCl晶体中钾离子、氯离子半径都大于镁离子、氧离子半径,镁离子、氧离子所带的电荷多,故MgO中离子键更强,故MgO的熔点更高;
故答案为:MgO;
(6)根据图1可知Fe原子的配位数为8,图2中Fe原子的配位数为12,故图1和图2的结构中铁原子的配位数之比为8:12=2:3;
故答案为:2:3.
点评:本题综合性较大,考查核外电子排布规律、分子结构与性质、熔沸点比较等,明确沸点的比较方法、氢键对物质性质的影响,需要学生具备扎实的知识和分析问题解决问题的能力,难度较大,(4)中构型判断是难点、易错点.

练习册系列答案
相关题目
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为