题目内容
(12分)铜和浓硫酸发生反应的化学方程式为: Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有 性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为: (写出序号)
①浓H2SO4 ②稀H2SO4 ③CuSO4
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O(1)浓H2SO4作_________剂,具有 性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子,还原了 mol H2SO4,生成 L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为: (写出序号)
①浓H2SO4 ②稀H2SO4 ③CuSO4
(1) 氧化剂 氧化性(2) 1 1 22.4 (3)①②③(每空2分)
判断依据:升失氧,降得还;依方程式进行氧化还原反应的计算。

练习册系列答案
相关题目
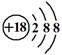
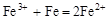
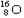
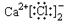
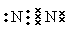
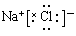
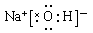
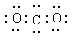

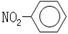

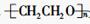 是通过加聚反应得到的产物
是通过加聚反应得到的产物