题目内容
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
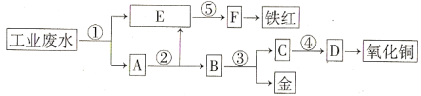
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
【答案】
(1)由铁屑;稀硫酸;稀硝酸;氢氧化钠;氢氧化钠;
(2)Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;Cu2++Fe=Cu+Fe2+;
2Au3++3Fe=2Au+3Fe2+;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(3)Fe2O3;用作红色涂料;用作制造铜盐的原料。
【解析】
试题分析:由工艺流程图示知,E为铁元素的离子,而A为铜、金的单质,通过过滤将铁元素与活泼性比它弱的铜、金分离出来,因此①处加入的物质为铁屑,发生的反应为Fe+2H+═Fe2++H2↑,2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2Au3++3Fe═2Au+3Fe2+;②处加入稀硫酸以除去铜、金中过量的铁屑,并将过滤后的硫酸亚铁溶液与含Fe2+的E溶液相混合;③处利用金不溶于硝酸的性质将铜与金分离开;④处将得到的铜离子用氢氧化钠转化为氢氧化铜沉淀,从而再受热分解为氧化铜;⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红(氧化铁)。
(1)由以上分析可知①铁屑;②稀硫酸;③稀硝酸;④氢氧化钠;⑤氢氧化钠,故答案为:铁屑;稀硫酸;稀硝酸;氢氧化钠;氢氧化钠;
(2)①处加入的物质为铁屑,发生的反应为Fe + 2H + .═ Fe2 + + H2↑,2Fe3 + + Fe ═ 3Fe2 + ,Cu2 + + Fe ═ Cu + Fe2 + ,2Au3 + + 3Fe ═ 2Au + 3Fe2 + ;③处利用金不溶于硝酸的性质将铜与金分离开,反应的化学方程式为3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O;
(3)⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红,常用作红色涂料,氧化铜常用作制造铜盐的原料,故答案为:Fe2O3;用作红色涂料;用作制造铜盐的原料。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案